
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.1mol苯甲酸在浓H2SO4存在下与足量乙醇反应可得1mol苯甲酸乙酯
B.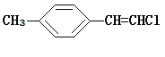 分子中的所有原子有可能共平面
分子中的所有原子有可能共平面
C.分子式为C5H12O的醇,能在铜催化下被O2氧化为醛的同分异构体有4种
D.1mol阿司匹林(结构简式见图)与足量的氢氧化钠溶液加热反应,最多消耗的氢氧化钠的物质的量2mol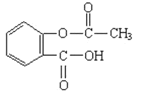
查看答案和解析>>
科目: 来源: 题型:
【题目】随着人们对硒的性质深入认识及产品硒的纯度提高,硒的应用范围越来越广。某科学小组以硫铁矿生产硫酸过程中产生的含硒物料(主要含S、Se、Fe2O3、CuO、ZnO、SiO2等)提取硒,设计流程如下:
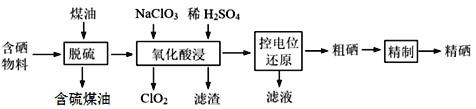
回答下列问题:
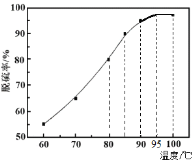
(1)“脱硫”时,测得脱硫率随温度的变化如图。随着温度的升高,脱硫率呈上升趋势,其原因是______。最佳温度是________。
(2)“氧化酸浸”中,Se转化成H2SeO3,该反应的离子方程式为_____________。
(3)采用硫脲[(NH2)2CS]联合亚硫酸钠进行“控电位还原”,将电位高的物质先还原,电位低的物质保留在溶液中,以达到硒与杂质金属的分离。下表是“氧化酸浸”液中主要粒子的电位。
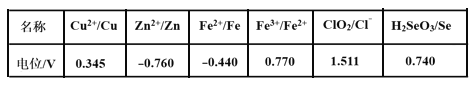
①控制电位在0.740~1.511V范围内,在氧化酸浸液中添加硫脲,可选择性还原ClO2。该过程的还原反应(半反应)式为___________。
②为使硒和杂质金属分离,用亚硫酸钠还原时的最低电位应控制在_____V。
(4)粗硒的精制过程:Na2SO3浸出[Se转化成硒代硫酸钠(Na2SeSO3)]→Na2S净化→H2SO4酸化等步骤。
①净化后的溶液中c(S2-)达到0.026 mol·L-1,此时溶液中的c(Cu2+)的最大值为________,精硒中基本不含铜。[Ksp(CuS)=1.3×10-36]
②硒代硫酸钠酸化生成硒的化学方程式为____________。
(5)对精硒成分进行荧光分析发现,精硒中铁含量为32 μg·g-1,则精硒中铁的质量分数为________ %,与粗硒中铁含量为0.89%相比,铁含量明显降低。
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物M是合成药物胃长宁的重要中间体,其典型的合成路线如下:
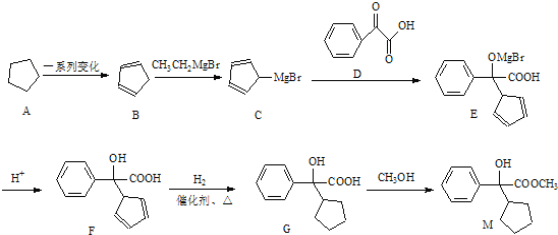
请回答下列问题:
(1)化合物M的分子式是________;
(2)C→E的反应类型是_____,化合物F中含氧官能团的名称为__________;
(3)下列有关化合物F的说法正确的是___________(用相应编号填写)
A.不能发生消去反应
B.核磁共振氢谱有7组峰
C.能使溴水褪色,并发生加成反应
D.在一定条件下能聚合成高分子化合物,其链节为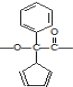
(4)写出G→M发生的化学反应方程式 _____________________________。
(5)化合物D有多种同分异构体,写出两种符合下列条件的同分异构体的结构简式____________________。
①属于芳香族化合物,且其苯环上的一氯取代物有2种
②能发生银镜反应 ③能与FeCl3溶液发生显色反应
查看答案和解析>>
科目: 来源: 题型:
【题目】羰基硫![]() 广泛存在于以煤为原料的各种化工原料气中,能引起催化剂中毒、化学产品质量下降和大气污染。有多种方法可以脱羰基硫中的硫,其中氢解和水解反应是两种常用的脱硫方法,
广泛存在于以煤为原料的各种化工原料气中,能引起催化剂中毒、化学产品质量下降和大气污染。有多种方法可以脱羰基硫中的硫,其中氢解和水解反应是两种常用的脱硫方法,
其反应式分别为:
①氢解反应:![]()
![]()
![]()
![]()
②水解反应:![]()
![]()
![]()
请回答下列问题:
(1)![]() 和
和![]() 能反应生成
能反应生成![]() 和
和![]() ,写出该反应的热化学方程式_______。
,写出该反应的热化学方程式_______。
(2)水解反应达到平衡后,若减小容器的体积,逆反应速率将______![]() 填增大、减少或不变,下同
填增大、减少或不变,下同![]() ,COS的转化率______。
,COS的转化率______。
(3)某温度下,体积为2L的恒容体系中,物质的量分别为m、n的COS蒸气和![]() 气发生氢解,已知COS的转化率为
气发生氢解,已知COS的转化率为![]() ,则该温度下的平衡常数表达式
,则该温度下的平衡常数表达式![]() ________________________
________________________![]() 用m、n、
用m、n、![]() 等符号表示
等符号表示![]() 。
。
(4)某科研小组研究改进催化剂![]() 和温度对COS水解的影响,得到如图
和温度对COS水解的影响,得到如图
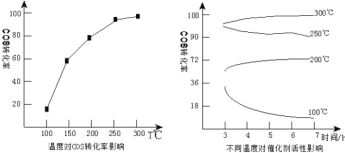
COS水解的最佳温度是__________________;理由是__________________________。
(5)研究表明,用金属储氢材料![]() 、白金
、白金![]() 、硫酸溶液组成的原电池可以发生羰基的氢解而脱硫处理。写出原电池的正极反应式____________________;
、硫酸溶液组成的原电池可以发生羰基的氢解而脱硫处理。写出原电池的正极反应式____________________;
查看答案和解析>>
科目: 来源: 题型:
【题目】硝酸铵是一种重要的化工原料,通常用合成氨及合成硝酸的产物进行生产
(1)硝酸铵水溶液pH__________7(填“>”、“=”或“<”),其水溶液中各种离子浓度大小关系为___________
(2)已知合成氨的热化学方程式为:N2(g)+ 3H2(g)![]() 2NH3(g)△H=-92kJ/mol,按照氮气和氢气的物质的量之比1:3的比例,分别在200℃、400℃、600℃的条件下进行反应,生成物NH3的物质的量分数随压强的变化曲线如图所示
2NH3(g)△H=-92kJ/mol,按照氮气和氢气的物质的量之比1:3的比例,分别在200℃、400℃、600℃的条件下进行反应,生成物NH3的物质的量分数随压强的变化曲线如图所示
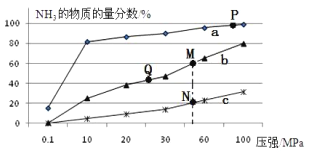
①曲线c对应的温度为___________ ℃
②下列说法中正确的是___________
A.增大氢气浓度,可促进平衡正向移动并能提高氮气的转化率
B.Q点对应的反应条件下,若加入适当的催化剂,可提高NH3在混合物中的物质的量分数
C.M、N两点的平衡常数大小关系为:M>N
D.M、N、Q三点反应速率的大小关系为:N>M>Q
E.为了尽可能多的得到NH3,应当选择P点对应的温度和压强作为生产条件
(3)尿素[CO(NH2)2]是一种非常重要的高效氮肥,工业上以NH3、CO2为原料生产尿素,该反应实际为两步反应:
第一步:2NH3(g)+CO2(g)=H2NCOONH4(s) ΔH=-272kJ·mol-1
第二步:H2NCOONH4(s)=CO(NH2)2(s)+H2O(g) ΔH=+138kJ·mol-1
写出工业上以NH3、CO2为原料合成尿素的热化学方程式:_________________________
(4)柴油汽车尾气净化器通常用尿素作为氮氧化物尾气的吸收剂,生成物均为无毒无污染的常见物质,请写出尿素与NO反应的化学方程式__________,当有1mol尿素完全反应时,转移电子的数目为___________
查看答案和解析>>
科目: 来源: 题型:
【题目】钛被称为“二十一世纪金属”,工业上用钛铁矿制备金属钛的工艺流程如下:
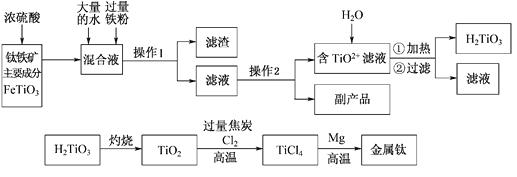
已知:钛铁矿主要成分与浓硫酸反应的主要产物是TiOSO4和FeSO4,TiOSO4遇水会水解。请回答下列问题:
(1)操作1用到的玻璃仪器除烧杯外还有________________________;
(2)请结合化学用语解释将TiO2+转化为H2TiO3的原理_____________________。
(3)已知钛的还原性介于铝与锌之间。如果可从Na、Zn、Fe三种金属中选一种金属代替流程中的镁,那么该金属跟四氯化钛反应的化学方程式是___________________________________。
(4)电解TiO2来获得Ti是以TiO2作阴极,石墨为阳极,熔融CaO为电解质,用碳块作电解槽,其阴极反应的电极反应式是_____________________________________。
(5)为测定溶液中TiOSO4的含量,先取待测钛液10 mL用水稀释至100 mL,加过量铝粉,充分振荡,使其完全反应:3TiO2+ +Al+6H+=3Ti3++Al3++3H2O。过滤后,取无色滤液20.00 mL,向其中滴加2~3滴KSCN溶液作指示剂,用______________________(填一种玻璃仪器的名称)滴加0.1000mol·L-1 FeCl3溶液,发生Ti3++Fe3+=Ti4++Fe2+。滴定终点时的现象是________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲装置中所含的是物质的量之比为1∶2的CuSO4和NaCl的混合溶液,电解过程中溶液的pH值随时间t变化的示意图如乙示(不考虑电解产物可能与水的反应)。试分析下列叙述中正确的是
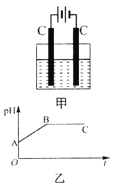
A.是该混合溶液中的SO42-导致了A点溶液的pH值小于B点
B.BC段阴极产物和阳极产物的体积之比为2∶1
C.AB线段与BC线段在阴极上发生的反应是相同的即:Cu2++2e-→Cu
D.在整个电解的过程中会出现少量淡蓝色的Cu(OH)2沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】某无色溶液中可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 这几种离子中的若干种,依次进行下列实验,观察到的现象记录如下:①
这几种离子中的若干种,依次进行下列实验,观察到的现象记录如下:①![]() 试纸检验,溶液的
试纸检验,溶液的![]() ②取少量原溶液,向溶液中加入过量的
②取少量原溶液,向溶液中加入过量的![]() 和盐酸的混合溶液,无白色沉淀生成③另取少量原溶液,向溶液中滴加足量氯水、无气体产生,再加入
和盐酸的混合溶液,无白色沉淀生成③另取少量原溶液,向溶液中滴加足量氯水、无气体产生,再加入![]() 振荡,静置后
振荡,静置后![]() 层呈橙色,用分液漏斗分液④向分液后的水溶液中加入
层呈橙色,用分液漏斗分液④向分液后的水溶液中加入![]() 和
和![]() 溶液,有白色沉淀产生⑤在滤液中加入
溶液,有白色沉淀产生⑤在滤液中加入![]() 和
和![]() 的混合溶液有白色沉淀产生。则关于原溶液的判断中正确的是
的混合溶液有白色沉淀产生。则关于原溶液的判断中正确的是
A.肯定不存在的离子是![]() 、
、![]() 、
、![]() 、
、![]()
B.肯定存在的离子是![]() 、
、![]() 、
、![]()
C.无法确定原溶液中是否存在![]() 和
和![]()
D.若步骤④改用![]() 和盐酸的混合溶液,则对溶液中离子的判断也无影响
和盐酸的混合溶液,则对溶液中离子的判断也无影响
查看答案和解析>>
科目: 来源: 题型:
【题目】在室温下,有下列五种溶液:
①0.1 mol/L NH4Cl
②0.1 mol/L CH3COONH4
③0.1 mol/L NH4HSO4
④0.1 mol/L NH3·H2O和0.1 mol/L NH4Cl混合液
⑤0.1 mol/L NH3·H2O
请根据要求填写下列空白:
(1)溶液①呈_____性(填“酸”“碱”或“中”),其原因是____________(用离子方程式表示)。
(2)溶液①②③⑤中c(NH4+)的关系由大到小排列是______。(用①②③⑤表示)
(3)室温下,测得溶液②的pH=7,则CH3COO-与NH4+浓度的大小关系是c(CH3COO-)________c(NH4+)(填“>”“<”或“=”)。
(4)已知室温下NH3·H2O的电离常数为1.8×10-5,通过计算可推知溶液④呈____性(填“酸”“碱”或“中”),溶液中离子浓度由小到大为____________(用离子符号表示),该温度下1 mol·L-1的NH4Cl溶液中c(H+)=_____ mol·L-1。(已知![]() ≈2.36),
≈2.36),
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是
A.pH相等的CH3COONa、NaOH和Na2CO3三种溶液浓度大小关系为:c(NaOH)<c(CH3COONa)<c(Na2CO3)
B.0.1 mol/L的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
C.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
D.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com