
科目: 来源: 题型:
【题目】一定温度下,将1molA(g)和1molB(g)充入2L密闭容器中发生反应:A(g)+B(g) ![]() xC(g)+D(s)△H<0,在 t1 时达平衡。在 t2 、t3 时刻分别改变反应的一个条件,测得容器中 C(g)的浓度随时间变化如图所示。下列有关说法正确的是
xC(g)+D(s)△H<0,在 t1 时达平衡。在 t2 、t3 时刻分别改变反应的一个条件,测得容器中 C(g)的浓度随时间变化如图所示。下列有关说法正确的是
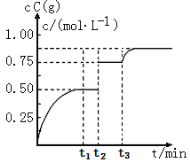
A. t2 时刻改变的条件是使用催化剂
B. t3时刻v(逆)可能小于t2 时刻v(逆)
C. t3时刻改变的条件一定是增大反应物的浓度
D. t1~t2、t2~t3平衡常数均为0.25
查看答案和解析>>
科目: 来源: 题型:
【题目】参照反应Br + H2 →HBr +H的能量对反应历程的示意图,下列叙述中正确的是( )
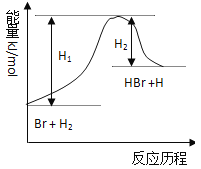
A.正反应为放热反应
B.加入催化剂,该化学反应的反应热不改变
C.加入催化剂,该化学反应的活化能不改变
D.加入催化剂可增大正反应速率,降低逆反应速率
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,下列反应的平衡常数的数值如下:
2NO(g)![]() N2(g)+O2(g) K1=1×1030;
N2(g)+O2(g) K1=1×1030;
2H2(g)+O2(g)![]() 2H2O(g) K2=2×1081;
2H2O(g) K2=2×1081;
2CO2(g)![]() 2CO(g)+O2(g) K3=4×10-92。
2CO(g)+O2(g) K3=4×10-92。
以下说法正确的是( )
A.常温下,NO分解产生O2的反应的平衡常数表达式为K1=c(N2)·c(O2)
B.常温下,水分解产生O2,此时平衡常数的数值约为5×10-82
C.常温下,NO、H2O、CO2三种化合物分解放出O2的倾向由大到小的顺序为NO>H2O>CO2
D.以上说法都不正确
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,甲、乙为相互串联的两电解池。
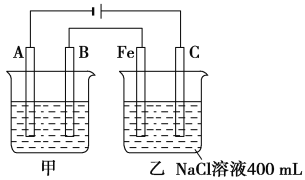
(1)甲池若为用电解原理精炼铜的装置,则A电极名称为________极,电极材料是________,电极反应式为_____________,电解质溶液可以是________。
(2)乙池中Fe极电极反应式为_________,若在乙池中滴入少量酚酞试液,开始通电一段时间,Fe极附近呈________色。
查看答案和解析>>
科目: 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。
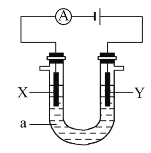
请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X极上的电极反应式为_______,在X极附近观察到的现象是_________
②Y电极上的电极反应式为_____________ 检验该电极反应产物的方法及现象是__________
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是_________________电极反应式是_________________。
②Y电极的材料是___________电极反应式是__________________。(说明:杂质发生的电极反应不必写出)
查看答案和解析>>
科目: 来源: 题型:
【题目】依据事实,写出下列反应的热化学方程式。
(1)甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态水。已知室温下1 g甲硅烷自燃放出热量44.6 kJ,其热化学方程式___________________。
(2)13 g C2H2(g)完全燃烧生成CO2和H2O(l)时,放出659 kJ的热量,该反应的热化学方程式为 ___________________。
(3)2.3 g某液态有机物和一定量的氧气混合点燃,恰好完全燃烧,生成2.7 g水和2.24 L CO2(标准状况),并放出68.35 kJ的热量,则该反应的热化学方程式为 ______________。
(4)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)= 2Fe(s)+3CO2(g) △H=-24.8 kJ·mol-1
3Fe2O3(s)+ CO(g)=2Fe3O4(s)+ CO2(g) △H=-47.2 kJ·mol-1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+640.5 kJ·mol-1
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是( )
A.电解池的阴极上发生失电子的氧化反应
B.用惰性电极电解Na2SO4溶液,阴、阳两极产物的物质的量之比为1∶2
C.用惰性电极电解饱和NaCl溶液,若有1 mol电子发生转移,则生成1 mol NaOH
D.酸溶液、碱溶液、盐溶液电解后,溶液的pH都增大
查看答案和解析>>
科目: 来源: 题型:
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注。采用离子交换膜控制电解液中OH一的浓度制备纳米级Cu2O的装置如图所示,发生的反应为:2Cu+H2O![]() Cu2O+H2↑。下列说法正确的是
Cu2O+H2↑。下列说法正确的是
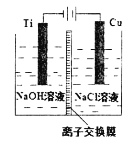
A.钛电极发生氧化反应
B.阳极附近溶液的pH逐渐增大
C.离子交换膜应采用阳离子离子交换膜
D.阳极反应式是:2Cu+2OH一一2e一== Cu2O+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生对Na2SO3与AgNO3在不同pH下的反应进行探究。
(1)测得Na2SO3溶液pH=10,AgNO3溶液pH=5,原因是(用离子方程式表示):___。
(2)调节pH,实验记录如下:
实验序号 | pH | 实验现象 |
a | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
b | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
c | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
查阅资料得知:
ⅰ.Ag2SO3:白色,难溶于水,溶于过量的Na2SO3溶液。
ⅱ.Ag2O:棕黑色,不溶于水,能和酸反应。
该学生对产生的白色沉淀提出了两种假设:
①白色沉淀为Ag2SO3。
②白色沉淀为Ag2SO4,推测的依据是___。
(3)取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解。该同学设计实验确认了白色沉淀不是Ag2SO4。实验方法是:另取Ag2SO4固体置于__溶液中,未溶解。
(4)将c中X滤出、洗净,为确认其组成,实验如下:
Ⅰ.向X中滴加稀盐酸,无明显变化。
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体。
Ⅲ.分别用Ba(NO3)2、BaCl2溶液检验Ⅱ中反应后的溶液,前者无明显变化,后者产生白色沉淀。
①实验Ⅰ的目的是___。
②根据实验现象分析,X的成分是___。
③Ⅱ中反应的化学方程式是___。
(5)该同学综合以上实验,分析产生X的原因:随着酸性的增强,体系的还原性增强。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和b附近分别滴加几滴石蕊溶液。下列实验现象中正确的是( )

A.逸出气体的体积,a电极的小于b电极的
B.一电极逸出无味气体,另一电极逸出刺激性气味气体
C.a电极附近呈红色,b电极附近呈蓝色
D.a电极附近呈蓝色,b电极附近呈红色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com