
科目: 来源: 题型:
【题目】CuCl晶体呈白色,熔点为430℃,沸点为1490℃,见光分解,露置于潮湿空气中易被氧化,难溶于水、稀盐酸、乙醇,易溶于浓盐酸生成H3CuCl4,反应的化学方程式为CuCl(s)+3HCl(aq)H3CuCl4(aq).
(1)实验室用如图1所示装置制取CuCl,反应原理为:
2Cu2++SO2+8Cl﹣+2H2O═2CuCl43﹣+SO![]() +4H+
+4H+
CuCl43﹣(aq)CuCl(s)+3Cl﹣(aq)
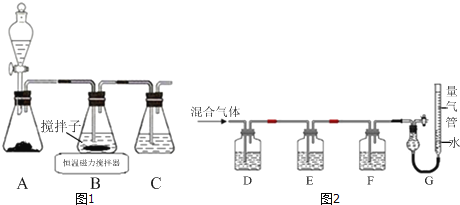
①装置C的作用是_____.
②装置B中反应结束后,取出混合物进行如图所示操作,得到CuCl晶体.
混合物![]()
![]()
![]()
![]()
![]() CuCl晶体
CuCl晶体
操作ⅱ的主要目的是_____
操作ⅳ中最好选用的试剂是_____.
③实验室保存新制CuCl晶体的方法是_____.
④欲提纯某混有铜粉的CuCl晶体,请简述实验方案:_____.
(2)某同学利用如图2所示装置,测定高炉煤气中CO、CO2、N2和O2的百分组成.
已知:
i.CuCl的盐酸溶液能吸收CO形成Cu(CO)ClH2O.
ii.保险粉(Na2S2O4)和KOH的混合溶液能吸收氧气.
①D、F洗气瓶中宜盛放的试剂分别是_____、_____.
②写出保险粉和KOH的混合溶液吸收O2的离子方程式:_____.
查看答案和解析>>
科目: 来源: 题型:
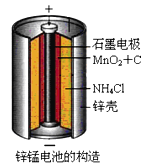
【题目】锌锰干电池是最早使用的化学电池,其基本构造如图1所示:
![]()
(1)锌锰干电池的电路中每通过![]() ,理论上负极质量减少 ______ g;工作时
,理论上负极质量减少 ______ g;工作时![]() 离子在正极放电产生两种气体,其中一种气体分子是含
离子在正极放电产生两种气体,其中一种气体分子是含![]() 的微粒,正极的电极反应式是 ______
的微粒,正极的电极反应式是 ______
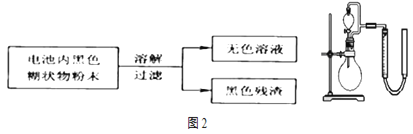
(2)某研究小组对电池内黑色糊状物进行了下列实验:
已知:![]() 是两性氢氧化物,完成下列实验报告:
是两性氢氧化物,完成下列实验报告:
实验步骤 | 实验现象 | 实验结论和解释 |
取少量上述无色溶液于试管中,逐滴加入NaOH溶液,直至过量,再加热 | 生成白色沉淀, ______ | 无色溶液中存在 检验 |
(3)利用残渣中分离出的![]() ,研究其在
,研究其在![]() 制
制![]() 过程中的作用.实验装置如图2所示。将等物质的量浓度、等体积
过程中的作用.实验装置如图2所示。将等物质的量浓度、等体积![]() 溶液加入烧瓶中,分别进行2个实验
溶液加入烧瓶中,分别进行2个实验![]() 气体的体积在相同条件下测定
气体的体积在相同条件下测定![]() 。
。
序号 | 烧瓶中的物质 | 实验记录 | 实验结论与解释 |
实验一 | 足量 | 收集到56mL气体 |
|
实验二 | 足量 | 黑色粉末部分溶解,收集到112mL气体 |
|
实验1、2中参加反应的![]() 的物质的量之比为 ______ ,实验二中反应的离子方程式为 ______。
的物质的量之比为 ______ ,实验二中反应的离子方程式为 ______。
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,在一个2L的密闭容器中,加入4 molA和2molB进行如下反应:
3A(g)+2B(g)![]() 4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是( )
4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是( )
A. 前2min,D的平均反应速率为0.2mol/(L·min)
B. 此时,B的平衡转化率是40%
C. 增加B,平衡向右移动,B的平衡转化率增大
D. 增大该体系的压强,平衡不移动
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2054 | 1535 | 1462 |
沸点/℃ | 2467 | 2980 | 2750 | -- |
I.该同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。请你设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是_______,反应的离子方程式为____________________________。
Ⅱ. 实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
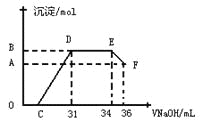
(1)图中OC段没有沉淀生成,此阶段发生反应的离子为:___________________。
(2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方为_________。
(3)当c=13mL时,原溶液中Fe3+与Al3+的物质的量之比为________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某科研小组模拟“人工树叶”电化学装置如下图所示,该装置能将H2O和CO2转化为糖类(C6H12O6)和O2,X、Y是特殊催化剂型电极,下列说法正确的是
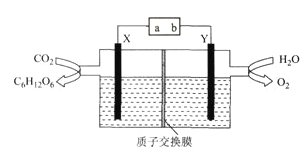
A. 电源a极为正极
B. 该装置中Y电极发生还原反应
C. X电极的电极反应式为6CO2+24H++24e-=C6H12O6+6H2O
D. 理论上,每生成22.4L(标准状况下)O2,必有4mol H+由X极区向Y极区迁移
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸亚铁在工农业生产中具有广泛的应用。该物质不稳定,受热易分解产生氧化物,具有较强的还原性。
Ⅰ.某学习小组利用如下装置米探究FeSO4受热分解的产物。
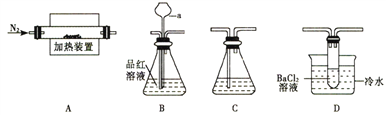
(1)甲组同学利用“A接B接C”的装置来验证产物中含有SO2气体。
①连接好装置后,接下来的操作是____________________。
②仪器a的名称是_______________;其作用是____________________。
(2)乙组同学查阅资料得:硫酸亚铁分解的气体产物中除SO2外还有SO3;SO3的熔点为16.8℃,沸点是46.8℃,溶于水放出大量的然,易形成酸雾。为此设计了“A接D接C”的装置验证产物中含有SO3。
①装置D中的现象是_________________,BaCl2溶液不能用Ba(NO3)2溶液代替的原因是______________________。
②装置A中固体变为经红棕色,结合两组同学的实验,写出硫酸亚铁分解的化学方程式______________________。
③取硫酸亚铁样品18.20g,加热分解至恒重时测得固体质量为11.00g(假设杂质不反应),该硫酸亚铁样品的纯度为__________%(保留小数点后两位,下同),样品中铁元素的质量分数为_____________。
Ⅱ.用硫酸亚铁碱性试纸可检验食品中是否含有CN-,方案如下:

已知:蓝色染料普鲁士蓝的合成方法如下:
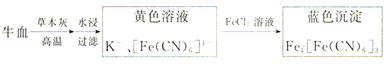
(3)若试纸变蓝则证明食品中含有CN-,基于普鲁士蓝的合成原理,请解释检测时试纸变蓝的原因______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】由U形管、质量为mg的铁棒、质量为mg的碳棒和1L0.2mol·L-1CuCl2溶液组成如图所示装置,下列说法不正确的是( )

A. 打开K,铁棒上有紫红色物质析出
B. 闭合K,碳棒上有紫红色固体析出
C. 闭合K,碳棒表面发生的电极反应为Cu2++2e-=Cu
D. 闭合K,当电路中有0.3NA个电子通过时,理论上碳棒与铁棒的质量差为9.6g
查看答案和解析>>
科目: 来源: 题型:
【题目】己知:图1中a和b分别为常温下盐酸和NaOH溶液互滴的pH变化曲线;图2为常温下CaSO4在水中的沉淀溶解平衡曲线[Ksp(CaSO4)=9×10-6]。下列相关叙述正确的是
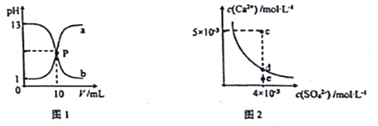
A. 图1中P点溶液:c(Na+)= c(Cl-)>c(H+) = c(OH-)
B. 由图1可知盐酸和NaOH溶液的浓度均为1mol·L-1
C. 图2中c点有沉淀生成,达平衡后溶液中c(SO42-)=3×10-3 mol·L-1
D. 可通过蒸发将图 2中e点的溶液变到d点
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组对一批未知成分的合金废料进行了如下处理:
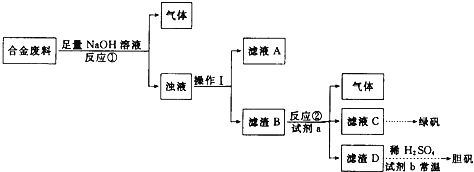
请回答下列问题:
![]() 分析上述实验流程,确定该合金中肯定含有的成分是 ______
分析上述实验流程,确定该合金中肯定含有的成分是 ______ ![]() 填化学式
填化学式![]() .
.
![]() 操作Ⅰ用到的玻璃仪器有 ______ 。
操作Ⅰ用到的玻璃仪器有 ______ 。
![]() 由滤渣D制取胆矾是一种绿色化学工艺.试剂b是一种常用的液态氧化剂,其化学式为 ______ ;写出该工艺中
由滤渣D制取胆矾是一种绿色化学工艺.试剂b是一种常用的液态氧化剂,其化学式为 ______ ;写出该工艺中![]() 胆矾的化学方程式 ______ 。
胆矾的化学方程式 ______ 。
![]() 甲、乙两位同学都验证了反应①生成的气体是氢气,甲同学认为合金中应含铝,但乙同学查阅资料得知硅也能与NaOH溶液反应生成
甲、乙两位同学都验证了反应①生成的气体是氢气,甲同学认为合金中应含铝,但乙同学查阅资料得知硅也能与NaOH溶液反应生成![]() 和
和![]() ,因此认为合金中可能含硅,也可能同时含有铝和硅。请设计方案证明合金中是否含有铝和硅
,因此认为合金中可能含硅,也可能同时含有铝和硅。请设计方案证明合金中是否含有铝和硅![]() 写出选用试剂、观察到的现象及结论
写出选用试剂、观察到的现象及结论![]() : ______ 。
: ______ 。
![]() 滤液C中铁元素的含量可以用酸性
滤液C中铁元素的含量可以用酸性![]() 溶液滴定法测定。用离子方程式表示该滴定法的反应原理: ______ 。
溶液滴定法测定。用离子方程式表示该滴定法的反应原理: ______ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A.Na+、Fe2+、Cl–、NO3–等离子能在甲基橙试液显红色的溶液中共存
B.K+、Mg2+、Cl–、I–等离子能在[H+] = 10–12 mol·L–1的溶液中共存
C.NaHS水解的离子方程式为:HS–+H2O ![]() S2–+H3O+
S2–+H3O+
D.NaHCO3的电离方程式为:NaHCO3=Na++HCO3–,HCO3– ![]() H++CO32–
H++CO32–
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com