
科目: 来源: 题型:
【题目】已知室温时,0.1 mol/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是( )
A. 该溶液的pH=4 B. 升高温度,溶液的pH和电离平衡常数均减小
C. 此酸的电离平衡常数约为1×10-7 D. 加入少量纯HA,电离程度减小电离平衡常数不变
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇作为基本的有机化工产品和环保动力燃料具有广阔的应用前景,CO2加氢合成甲醇是合理利用CO2的有效途径,由CO2制备甲醇过程可能涉及反应如下:
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.58kJ/mol
CH3OH(g)+H2O(g) △H1=-49.58kJ/mol
反应Ⅱ:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g)![]() CH3OH(g) △H3=-90.77kJ/mol
CH3OH(g) △H3=-90.77kJ/mol
回答下列问题:
(1)反应Ⅱ的△H2=______ ,反应 I自发进行条件是 ______(填“较低温”、“较高温”或“任何温度”)。
(2)在一定条件下3 L恒容密闭容器中,充入一定量的H2和CO2仅发生反应Ⅰ,实验测得反应物在不同起始投入量下,反应体系中CO2的平衡转化率与温度的关系曲线,如图1所示。
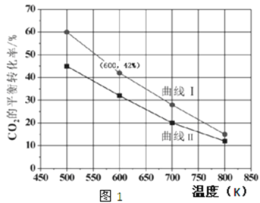
①H2和CO2的起始的投入量以A和B两种方式投入
A:n(H2)=3 mol,n(CO2)=1.5 mol B:n(H2)=3 mol,n(CO2)=2 mol,
曲线 I代表哪种投入方式______(用A、B表示)。
②在温度为500K的条件下,按照A方式充入3 molH2和1.5 molCO2,该反应10 min时达到平衡:
a.此温度下的平衡常数为______;500K时,若在此容器中开始充入0.3 mol H2和0.9 molCO2、0.6 mol CH3OH、x mol H2O,若使反应在开始时正向进行,则x应满足的条件是 ______。
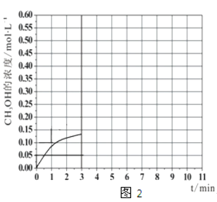
b.在此条件下,系统中CH3OH的浓度随反应时间的变化趋势如图2所示,当反应时间达到3 min时,迅速将体系温度升至600 K,请在图2中画出3~10 min内容器中CH3OH浓度的变化趋势曲线__________。
(3)化物燃料电池是一种新型的燃料电池,它是以固体氧化锆氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过,该电池的工作原理如图3所示,其中多孔电极均不参与电极反应,图3是甲醇燃料电池的模型。
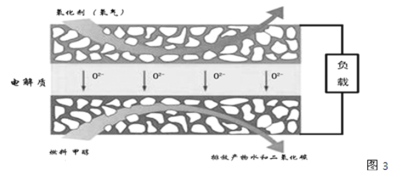
①写出该燃料电池的负极反应式 ______。
②如果用该电池作为电解装置,当有16 g甲醇发生反应时,则理论上提供的电量最多为 ______(法拉第常数为9.65×104C/mol)
查看答案和解析>>
科目: 来源: 题型:
【题目】在10 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) ![]() M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
n(X) | n(Y) | n(M) | |||
① | 700 | 0.40 | 0.10 | 0.090 | |
② | 800 | 0.10 | 0.40 | 0.080 | |
③ | 800 | 0.20 | 0.30 | a | |
④ | 900 | 0.10 | 0.15 | b | |
下列说法正确的是( )
A. 实验①中,若5 min时测得n(M)=0.050 mol,则0至5 min时间内,用N表示的平均反应速率v(N)=1.0×10-2 mol·L-1·min-1
B. 实验②中,该反应的平衡常数K=2.0
C. 实验③中,达到平衡时,X的转化率为60%
D. 实验④中,达到平衡时,b>0.060
查看答案和解析>>
科目: 来源: 题型:
【题目】煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。已知:CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数随温度的变化如下表:下列叙述正确的是
CO2(g)+H2(g)的平衡常数随温度的变化如下表:下列叙述正确的是
温度/℃ | 400 | 500 | 830 | 1000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
A. 该反应的正反应是吸热反应
B. 该反应达到平衡后,保持容器休积不变升高温度,正反应速率不变,容器内混合气体的压强不变
C. 830℃时,在恒容反应器中按物质的量比n(CO):n(H2O):n(H2):n(CO2)=2:4:6:1投入反应混合物发生上述反应,初始时刻v正<v逆
D. 830℃时,在2L的密闭容器中加入4molCO(g)和6molH2O(g)达到平衡时,CO的转化率是60%
查看答案和解析>>
科目: 来源: 题型:
【题目】用1.0mol/L的NaOH溶液中和某浓度的H2SO4溶液,其水溶液的pH和所用NaOH溶液的体积变化关系如图所示,则原H2SO4溶液的物质的量浓度和完全反应后溶液的大致体积是( )
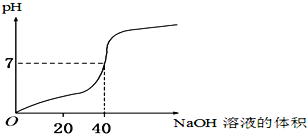
A.1.0 mol/L,20 mL B.0.5 mol/L,40 mL
C.0.5 mol/L,80 mL D.1.0 mol/L,80 mL
查看答案和解析>>
科目: 来源: 题型:
【题目】能使H2O+H2O![]() H3O++OH-电离平衡向正反应方向移动,且所得溶液呈酸性的是
H3O++OH-电离平衡向正反应方向移动,且所得溶液呈酸性的是
A.在水中加Na2CO3固体B.在水中加入CuCl2固体
C.在水中加入稀硫酸D.将水加热到99℃,其中c(H+)=1×10-6mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下存在反应:C(s)+H2O(g)![]() CO(g)+H2(g) △H>0,向甲、乙、丙三个恒容容器中加入一定量的初始物质,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示:
CO(g)+H2(g) △H>0,向甲、乙、丙三个恒容容器中加入一定量的初始物质,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示:
容器 | 甲 | 乙 | 丙 |
|
容积/L | 1 | 1 | V | |
温度/℃ | T1 | T2 | T1 | |
起始量 | 2 molC(s)、2 mol H2O(g) | 2 mol CO(g)、2 mol H2(g) | 6 molC(s)、 4mol H2O(g) |
下列说法正确的是( )
A.甲容器中,0~5min内的平均反应速率v(CO)=0.1 mol/(L·min)
B.乙容器中,若平衡时n(C)=0.56 mol,则T2>T1
C.温度为T1时,反应的平衡常数为K=9
D.丙容器的容积V=0.8 L
查看答案和解析>>
科目: 来源: 题型:
【题目】碳族、氮族元素及其化合物在生产、生活和环境保护中应用广泛。
(1)下列有关物质性质递变的描述中,正确的是________________(填代号)。
A.酸性:HNO3>H2CO3>H2SiO3 B.稳定性:NH3>AsH3>PH3
C.稳定性:N2<P4(白磷) D.常温下,同浓度溶液的pH:Na3PO4<Na3AsO4
(2)已知:
(a)CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890.3 kJ·mol1
(b)2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6 kJ·mol1
(c)C(s)+O2(g)=CO2(g) ΔH3=-393.5 kJ·mol1
①C(s)+2H2(g)=CH4(g) ΔH=___________kJ·mol1。
②CH4制备合成气的原理是CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
A. 下列叙述不能表示该反应在恒温恒容条件下达到平衡状态的是____。
a. 混合气体的压强不再发生变化
b. 混合气体的密度不再发生变化
c. 反应容器中CO2、CO的物质的量的比值不再发生变化
d. 混合气体的平均相对分子质量不再发生变化
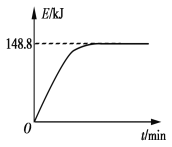
B. 若1 g CH4(g)完全反应吸收热量为15.5 kJ。在恒容密闭容器中充入1 mol CH4和1 mol CO2在一定条件下反应,体系吸收热量随着时间变化如图所示。在该条件下,甲烷的最大转化率(α)为____________。
(3)在密闭容器中发生反应:2NO(g)+H2(g)= N2(g)+2H2O(g),其反应速率与浓度关系式为v=kcm(NO)·cn(H2)(k为常数,只与温度有关,m、n为反应级数,取正整数),在某温度下测得有关数据如表所示。
序数 | c(NO)/(mol·L1) | c(H2)/(mol·L1) | v/(mol·L1·min1) |
Ⅰ | 0.10 | 0.10 | 0.414 |
Ⅱ | 0.20 | 0.20 | 3.312 |
Ⅲ | 0.10 | 0.20 | 0.828 |
总反应分两步进行:第i步,2NO+H2=N2+H2O2(很慢);第ii步,H2O2+H2![]() 2H2O(很快)。在上述温度下,当c(NO)=c(H2)=0.50 mol·L1时v=_________mol·L1·min1。
2H2O(很快)。在上述温度下,当c(NO)=c(H2)=0.50 mol·L1时v=_________mol·L1·min1。
(4)在2 L恒容密闭容器中充入3 mol NO(g)和3 mol CO(g),发生反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g),在一定温度下达到平衡,测得平衡体系中c(N2)=0.5 mol·L1。则该条件下平衡常数K值为_______。反应前后容器内气体压强之比为_________________________。
N2(g)+2CO2(g),在一定温度下达到平衡,测得平衡体系中c(N2)=0.5 mol·L1。则该条件下平衡常数K值为_______。反应前后容器内气体压强之比为_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(15分)草酸钴用途广泛,可用于指示剂和催化剂制备。一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4·2H2O工艺流程如下:
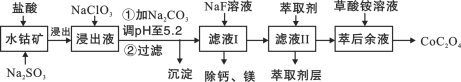
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3的目的是将_____________还原(填离子符号)。
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,产物中氯元素处于最低化合价。该反应的离子方程式为____________。
(3)请用平衡移动原理分析加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因是:________。
(4)萃取剂对金属离子的萃取率与pH的关系如图所示。
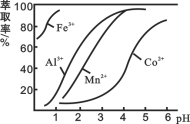
滤液Ⅱ中加入萃取剂的作用是_________;使用萃取剂适宜的pH是______。
A.接近2.0 B.接近3.0 C.接近4.0
(5)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液c(Mg2+)/ c (Ca2+)=____。
查看答案和解析>>
科目: 来源: 题型:
【题目】Cr2O72-、Cr3+对环境具有极强的污染性,含有Cr2O72-、Cr3+的工业废水常采用NaOH沉淀法除去。已知:①常温下,Cr3+完全沉淀(c≤1.0×105 mol· L1) 时,溶液的pH为5;NaOH过量时Cr(OH)3溶解生成CrO2-:Cr3++3OH ![]() Cr(OH)3
Cr(OH)3 ![]() CrO2-+H++H2O。②CrO2-还原产物为Cr3+。③ lg3.3=0.50。请回答下列问题:
CrO2-+H++H2O。②CrO2-还原产物为Cr3+。③ lg3.3=0.50。请回答下列问题:
(1)常温下,Cr(OH)3的溶度积常数Ksp[Cr(OH)3]=__________。
(2)常温下,向50 mL 0.05 mol·L1的Cr2(SO4)3溶液中加入1.0 mol·L1的NaOH溶液50 mL,充分反应后,溶液pH为____________。
(3)为了测定工业废水中Na2Cr2O7的浓度,进行如下步骤:
Ⅰ.取100 mL滤液;
Ⅱ.用c mol·L1的标准KMnO4酸性溶液滴定b mL一定浓度的FeSO4溶液,消耗KMnO4溶液b mL;
Ⅲ.取b mL滤液,用上述FeSO4溶液滴定,达到滴定终点时,消耗d mL FeSO4溶液。
①步骤Ⅱ中的滴定过程应选用_______(填“酸式”或“碱式”)滴定管,滴定终点的现象是__________________。
②步骤Ⅲ的滤液中Na2Cr2O7的含量为_______mol·L1。
(4)Na2Cr2O7的含量也可以用一定难度的NaNO2溶液进行滴定。已知常温下HNO2的电离常数Ka=7.1×10-4 ,NH3·H2O的电离常数Kb=1.7×10-5 。0.1 mol·L-1 NH4NO2溶液中各离子浓度由大到小的顺序是______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com