
科目: 来源: 题型:
【题目】工业上电解MnSO4溶液制备Mn和MnO2,工作原理如图所示,下列说法不正确的是
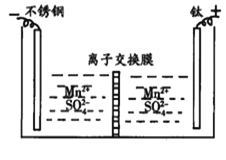
A.阳极区得到H2SO4
B.阳极反应式为Mn2+-2e-+2H2O=MnO2+4H+
C.离子交换膜为阳离子交换膜
D.当电路中有2mole-转移时,生成55gMn
查看答案和解析>>
科目: 来源: 题型:
【题目】已知反应:2NO2(红棕色)![]() N2O4(无色)△H<0.将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是( )
N2O4(无色)△H<0.将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是( )
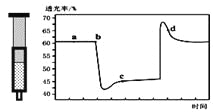
A. b点的操作是压缩注射器
B. c点与a点相比,c(NO2)增大,c(N2O4)减小
C. d 点:v(正)>v(逆)
D. 若不忽略体系温度变化,且没有能量损失,则T(b)>T(c)
查看答案和解析>>
科目: 来源: 题型:
【题目】化学研究小组用如图装置测定锌(含有少量铜)的纯度,下列操作能达到实验目的的是( )
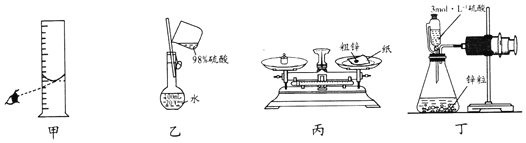
A.用装置甲量取一定体积的浓硫酸
B.用装置乙配制100mL3mo1L-1的稀硫酸
C.用装置丙称量一定质量的粗锌
D.用装置丁测量金属锌与稀硫酸反应产生氢气的体积
查看答案和解析>>
科目: 来源: 题型:
【题目】钼酸钠(Na2MoO4)是一种重要的化工原料。用废加氢催化剂(含有MoS2和Al2O3、Fe2O3、SiO2等)为原料制取钼酸钠,工艺流程如图所示:

已知:MoO3、A12O3在高温下能跟Na2CO3发生反应。
回答下列问题:
(1)Na2MoO4中Mo元素的化合价______。
(2)废加氢催化剂焙烧目的是脱除表面油脂、硫等。请根据表中实验数据分析,废加氢催化剂预处理温度应选择______℃。
废催化剂在不同温度下的烧残(时间:2h)
温度 /℃ | 300 | 350 | 400 | 500 | 600 |
烧前 /g | 50.00 | 50.00 | 50.00 | 50.00 | 50.00 |
烧后 /g | 48.09 | 47.48 | 47.19 | 46.55 | 46.52 |
烧残, % | 96.2 | 95.0 | 94.4 | 93.1 | 93.0 |
(3)焙烧时生成MoO3的化学方程式为______,当生成1mol MoO3转移电子数为______NA。
(4)加碳酸钠碱性焙烧时主要反应的化学方程式为______。
(5)用50t含MoS2为80%的废加氢催化剂,经过制取、分离、提纯,得到30.9t Na2MoO4,则Na2MoO4的产率为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组离子在指定环境中一定能大量共存的是( )
A.pH=1的溶液中:Fe2+、NO3、SO42、Na+
B.存在较多Fe3+的溶液中:Na+、SCN、CO32、K+
C.常温下水电离出的c(H+)=10-12mol/L的溶液中::NH4+、Cl、CO32、F
D.在能使红色石蕊试纸变蓝色的溶液中:Na+、CO32、S2、NO3
查看答案和解析>>
科目: 来源: 题型:
【题目】化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
A.碱性锌锰干电池的负极反应式为:MnO2+2H2O-2e=Mn(OH)2+2OH
B.铅蓄电池放电时,正极反应式为PbO2+4H++SO42+2e=PbSO4+2H2O
C.NaHS水解反应方程式:HS+H2O ![]() H3O++S2
H3O++S2
D.过量的SO2通入到漂白粉溶液中,反应方程式:ClO+SO2+H2O=HClO+HSO3
查看答案和解析>>
科目: 来源: 题型:
【题目】下列变化不能用勒夏特列原理解释的是( )
A.向H2S水溶液中加入NaOH有利于S2-增多
B.过氧化氢分解加催化剂二氧化锰,使单位时间内产生的氧气的量增多
C.合成氨时将氨液化分离,可提高原料的利用率
D.新制氯水久置后颜色变浅
查看答案和解析>>
科目: 来源: 题型:
【题目】随着我国工业化水平的不断发展,解决水、空气污染问题成为重要课题。
(1)汽车尾气的大量排放是造成空气污染的重要因素之一,发展燃料电池汽车可以有效地解决上述问题。直接甲醇燃料电池(DMFC)不会产生有害产物,能量转换效率比内燃机要高2~3倍,电池结构如图所示,c处通入的物质为为______,外电路中电子从______到______(填“A”或“B”)移动,写出电池负极的电极反应方程式______________
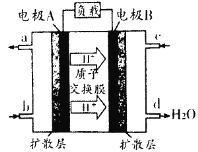
(2)工业废水中常含有一定量的Cr2O72-,会对人类及生态系统产生很大损害,电解法是处理铬污染的常用方法。该法用Fe做电极电解含Cr2O72-的酸性废水,电解时,在阴极上有大量气泡生成,并产生Cr(OH)3、Fe(OH)3沉淀。
①反应中,1molCr2O72-完全生成Cr(OH)3沉淀,外电路通过电子的物质的量为_________ mol。
②常温下,Cr(OH)3的溶度积Ksp=10-12(mol/L)4,当Cr3+浓度小于![]() mol
mol![]() 时可认为完全沉淀,电解完全后,测得溶液的pH=6,则该溶液过滤后为___________(填“能”或“否”)直接排放。
时可认为完全沉淀,电解完全后,测得溶液的pH=6,则该溶液过滤后为___________(填“能”或“否”)直接排放。
(3)含氨废水易引发水体富营养化。向NH4Cl溶液中加入少量NaOH固体,溶液中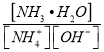 ________(填“增大”“减小”或“不变”);
________(填“增大”“减小”或“不变”);![]() 时,NH3H2O的电离平衡常数Kb=1.8×10-5mol/L,该温度下,1mol
时,NH3H2O的电离平衡常数Kb=1.8×10-5mol/L,该温度下,1mol![]() 的NH4Cl溶液中c(H+)=_______mol/L。(已知
的NH4Cl溶液中c(H+)=_______mol/L。(已知![]() )
)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:25°C时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11,下列说法正确的是
A.25°C时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
B.25°C时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大
C.25°C时,Mg(OH)2固体在20mL 0.01 mol/L氨水中的Ksp比在20mL 0.01mol/L NH4Cl溶液中的Ksp小
D.25°C时,在Mg(OH)2的悬浊液加入浓NaF溶液后,Mg(OH)2不可能转化成为MgF2
查看答案和解析>>
科目: 来源: 题型:
【题目】铵明矾[NH4Al(SO4)2·12H2O]是分析化学常用的基准试剂,工业上常用铝土矿(主要成分为Al2O3)来生产铵明矾,其中Z的水溶液可用于伤口消毒,其工艺流程图如下:
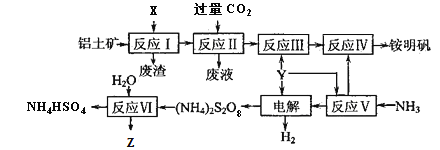
(1)写出反应Ⅱ的离子方程式____________________。
(2)25℃时,将0.2 mol·L-1的氨水与0.1 mol·L-1的Y溶液等体积混合,所得溶液的pH=5,则该温度下氨水的电离常数Kb≈_____________(忽略混合时溶液体积的变化)。
(3)从反应Ⅳ的铵明矾溶液中获得铵明矾晶体的实验操作依次为_____________、____________、过滤、洗涤(填操作名称)。
(4)“电解”时,用惰性材料作电极,则阳极电极反应式为__________________________。
(5)反应Ⅵ的化学方程式为______________________。
(6)废水中含有Fe2+、Mn2+等金属离子对自然环境有严重的破坏作用,,可用(NH4)2S2O8氧化除去。写出Mn2+被氧化生成MnO2的离子方程式为__________________________________。Z也有较强氧化性,在实际生产中不用Z氧化Mn2+的原因是_______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com