
科目: 来源: 题型:
【题目】某化学兴趣小组对加碘食盐中碘酸钾进行研究,查阅资料得知:碘酸钾是一种白色粉末,常温下很稳定,加热至560℃开始分解。在酸性条件下碘酸钾是一种较强的氧化剂与HI、H2O2等物质作用,被还原为单质碘。
(1)学生甲设计实验测出加碘食盐中碘元素的含量,步骤如下:
①称取wg加碘盐,加适量蒸馏水溶解。
②用稀硫酸酸化所得的溶液,再加入过量KI溶液,写出该步反应的离子方程式:_______。
③以淀粉为指示剂,用物质的量浓度为1.00×10-3molL-1的Na2S2O3溶液滴定![]() 滴定时的反应方程式为
滴定时的反应方程式为![]() ,滴定时Na2S2O3溶液应放在 ______
,滴定时Na2S2O3溶液应放在 ______ ![]() 填“酸式滴定管”或“碱式滴定管”
填“酸式滴定管”或“碱式滴定管”![]() ,滴定至终点的现象为_______________。
,滴定至终点的现象为_______________。
(2)学生乙对纯净的NaCl(不含KIO3)进行了下列实验:
顺序 | 步骤 | 实验现象 |
① | 取少量纯净的NaCl,加适量蒸馏水溶解 | 溶液无变化 |
② | 滴入少量淀粉-KI溶液,振荡 | 溶液无变化 |
③ | 然后再滴加稀硫酸,振荡 | 溶液变蓝色 |
请推测实验③中产生蓝色现象的可能原因: __________________ ;根据学生乙的实验结果可推测学生甲的实验结果可能 ______ (填“偏大”、“偏小”或“无影响”)。
(3)学生丙设计实验证明加碘食盐样品中碘元素的存在形式是IO3-而不是I-,进行如下实验。写出实验步骤、预期现象和结论。限选试剂:稀硫酸、稀硝酸、3% H2O2溶液、新制氯水、1%淀粉溶液、蒸馏水。
实验步骤 | 预期现象和结论 |
步骤1:取少量食盐样品于试管中,加适量蒸馏水使其完全溶解, _____________________ | ______ |
步骤2:另取少量食盐样品于试管中,加适量蒸馏水使其完全溶解,滴入适量的稀硫酸酸化, _____________________ | ______ |
查看答案和解析>>
科目: 来源: 题型:
【题目】一种利用电解锰阳极泥(主要成分MnO2、MnO)制备MnO2的工艺流程如下:
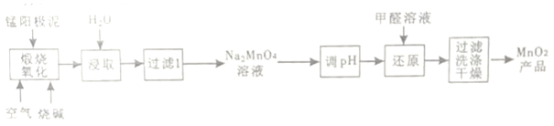
(1)“煅烧氧化”时,1mol MnO煅烧完全转化为Na2MnO4失去电子的物质的量为___________;MnO2煅烧反应的化学方程式为__________________。
(2)“浸取”时,为提高Na2MnO4的浸取率,可采取的措施有____________、____________(列举2点)
(3)“调pH”是将溶液pH 调至约为10,防止pH较低时Na2MnO4自身发生氧化还原反应,生成MnO2和___________;写出用pH试纸测定溶液pH的操作_______________。
(4)“还原”时有无机含氧酸盐生成,发生反应的化学方程式为_____________。
(5)测定产品中MnO2质量分数的步骤如下:
步骤1. 准确称取mg产品,加入c1mol·L-1Na2C2O4溶液V1mL (过量)及适量的稀硫酸,水浴加热煮沸一段时间。(已知:Na2C2O4+2H2SO4+MnO2=MnSO4+2CO2↑+2H2O+Na2SO4)
步骤2. 然后用c2mol·L-1KMnO4标准溶液滴定剩余的Na2C2O4滴定至终点时消耗KMnO4标准溶液V2mL。(已知:5H2C2O4+2KMnO4+3H2SO4=2MnSO4+10CO2↑+K2SO4+8H2O)
步骤2达滴定终点时判断依据是_____________;产品中MnO2的质量分数为ω(MnO2)=____________(列出计算的表达式即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t ℃时AgCl的Ksp=4×10-10 mol2·L-2,下列说法不正确的是( )
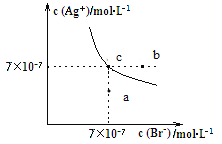
A.在t ℃时,AgBr的Ksp为4.9×10-13 mol2·L-2
B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点
C.图中a点对应的是AgBr的不饱和溶液
D.在t ℃时,AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)的平衡常数K≈816
AgBr(s)+Cl-(aq)的平衡常数K≈816
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)已知:![]() 石墨
石墨![]()
![]()
![]() 石墨
石墨![]()
则4Fe![]() ______
______
(2)一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图1所示:用Z表示的反应速率为______![]() ,写出该反应的化学方程式______,又反应开始到10s时,Y的转化率为______。
,写出该反应的化学方程式______,又反应开始到10s时,Y的转化率为______。
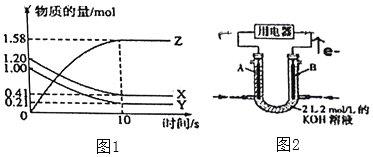
(3)图2为乙烷![]() 燃料电池的装置
燃料电池的装置![]() 、B为多孔碳棒
、B为多孔碳棒![]() :______
:______![]() 填A或
填A或![]() 处电极入口通乙烷,其电极反应式为______。
处电极入口通乙烷,其电极反应式为______。
(4)用中和滴定法测定溶液碱溶液的浓度。
①滴定时,用![]() 的盐酸来滴定待测溶液,若选用甲基橙作指示剂,滴定终点的判断方法是______。
的盐酸来滴定待测溶液,若选用甲基橙作指示剂,滴定终点的判断方法是______。
②下列操作![]() 其他操作正确
其他操作正确![]() 造成测定结果偏低是______
造成测定结果偏低是______
A.滴定终点读数时俯视读数
B.酸式滴定管使用前水洗后未用标准盐酸溶液润洗
C.锥形瓶水洗用待测液润洗
D.酸式滴定管尖嘴部分有气泡,滴定后消失
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A(g)+B(g)=2C(g),反应过程中C的百分含量与温度关系如图,下列正确的是

A.正反应速率:v(c)>v(d)>v(b)
B.化学平衡常数:K(d)>k(c)
C.c向d变化时,v(正)<v(逆)
D.d点状态加入合适的催化剂可使c%增大
查看答案和解析>>
科目: 来源: 题型:
【题目】为测定人体血液中Ca2+的含量,设计了如下方案:
![]()
有关反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4 K2SO4+2MnSO4+10CO2↑+8H2O若血液样品为15mL,滴定生成的草酸消耗了0.001mol·L-1的KMnO4溶液15.0mL,则这种血液样品中的含钙量为
A.0.001mol·L-1B.0.0025mol·L-1 C.0.0003mol·L-1D.0.0035mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,可逆反应 2NO2(g)![]() 2NO(g)+O2(g)在体积固定的密闭容器中反应, 达到平衡状态的标志是( )
2NO(g)+O2(g)在体积固定的密闭容器中反应, 达到平衡状态的标志是( )
①单位时间内生成 n mol O2,同时生成 2n mol NO2
②v 正(NO)=v 逆(NO2)
③每消耗 32g 氧气,同时生成 60g NO
④混合气体的压强不再改变
⑤混合气体的颜色不再改变
⑥混合气体的平均相对分子质量不再改变
⑦混合气体的密度不再改变
A.①④⑤⑥B.①②③⑤C.①②③④⑤D.①②③④⑤⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,用0.100mol/L NaOH 溶液分别滴定20.00mL 0.100mol/L的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是
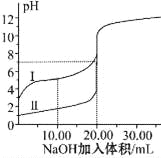
A. Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线
B. V(NaOH)=10.00 mL 时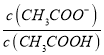 >1
>1
C. pH=7时,两种酸所用NaOH溶液的体积相等
D. V(NaOH)=20.00 mL 时,c(Cl-)<c(CH3COO-)
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是某同学设计的原电池装置,下列叙述中正确的是( )
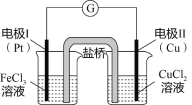
A.电极Ⅰ上发生还原反应,作原电池的负极
B.盐桥中装有含氯化钾的琼脂,其作用是传递电子
C.该原电池的总反应为: Fe3++Cu=Cu2++Fe2+
D.电极Ⅱ的电极反应式为:Cu-2e-=Cu2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com