
科目: 来源: 题型:
【题目】我国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25gL-1。某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。
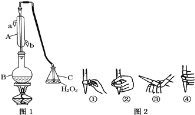
(1)仪器A的名称是 ______,水通入A的进口为 ______。
(2)B中加入300.00mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为 ______
(3)除去C中过量的H2O2,然后用0.090 0molL-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的 ______ ;若滴定终点时溶液的pH=8.8,则选择的指示剂为 ______ ;若用50mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积(填序号) ______ (①=10mL;②=40mL;③<10mL;④>40mL)
(4)滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2含量为:______ gL-1。
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施:______。
(6)常温下,用一定量的NaOH溶液吸收逸出的SO2气体,吸收后的吸收液恰好呈中性,下列关于吸收液的说法正确的是______
A. ![]()
B. ![]()
C. ![]()
D. ![]()
E. 
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)已知在氨水中存在下列平衡:NH3·H2O![]() NH4++OH-。
NH4++OH-。
①向氨水中加入NH4Cl固体时,平衡__移动(填“向右”或“向左”),c(OH-)__(填“增大”或“减小”)。
②向氨水中加水稀释时,平衡___移动(填“向右”或“向左”)。
(2)FeCl3净水的原理是(用离子方程式表示)__,将AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是__(写化学式)。
(3)已知草酸是二元弱酸,常温下测得0.1mol/L的KHC2O4的pH为4.8,则此KHC2O4溶液中c(C2O42-)__c(H2C2O4)(填“大于”或“小于”或“等于”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL)。
Ⅰ.实验步骤:
(1)配制100mL待测白醋溶液。用__(填仪器名称)量取10.00mL食用白醋,注入烧杯中用水稀释后转移到100mL容量瓶中,洗涤,定容,摇匀即得。
(2)取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴__作指示剂。
(3)读取盛装0.1000mol/LKOH溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为__mL。

(4)滴定:当__时,停止滴定,并记录KOH溶液的终点读数,重复滴定3次。
Ⅱ.实验记录:
滴定次数 实验数据(mL) | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(KOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论:
(1)经计算,市售白醋总酸量=__g/100mL。
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是__(填写选项字母)。
A.碱式滴定管在滴定前未用标准KOH溶液润洗
B.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
C.锥形瓶中加入待测白醋溶液后,再加少量水
D.锥形瓶在滴定时剧烈摇动,有少量液体溅出
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化碳是用途非常广泛的化工基础原料,回答下列问题:
(1)工业上可以用CO2来生产燃料甲醇。
已知:CO2(g)+3H2(g)![]() CH3OH(l)+H2O(l) ΔH1=-131.0kJ·mol-1
CH3OH(l)+H2O(l) ΔH1=-131.0kJ·mol-1
H2(g)+![]() O2(g)=H2O(l) ΔH2=-285.8kJ·mol-1
O2(g)=H2O(l) ΔH2=-285.8kJ·mol-1
则CH3OH的燃烧热ΔH=__。
(2)在催化剂作用下,CO2和CH4可以直接转化为乙酸:CO2(g)+CH4(g)![]() CH3COOH(g) ΔH=+36.0kJ·mol-1
CH3COOH(g) ΔH=+36.0kJ·mol-1
欲使乙酸的平衡产率提高,应采取的措施是__(填标号)。
A.升高温度 B.降低温度 C.增大压强 D.降低压强
(3)高温下,CO2与足量的碳在密闭容器中实现反应:C(s)+CO2(g)![]() 2CO(g)。
2CO(g)。
①该反应的平衡常数表达式K=__。
②向容积为1L的恒容容器中加入足量的碳和0.2molCO2,在不同温度下达到平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示。
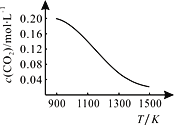
则该反应为__(填“放热”或“吸热”)反应。某温度下,若向该平衡体系中再通入0.2molCO2,达到新平衡后,体系中CO的百分含量__(填“变大”或“变小”或“不变”),平衡常数__(填“变大”或“变小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.(1)工业废水中常含有Cu2+等重金属离子,直接排放会造成污染,目前在工业废水处理过程中,依据沉淀转化的原理,常用FeS等难溶物质作为沉淀剂除去这些离子。已知室温下Ksp(FeS)=6.3×10-18,Ksp(CuS)=1.3×10-36。请用离子方程式说明上述除杂的原理__。
(2)在t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,则该温度下水的离子积常数KW=__。在该温度下,将100mL0.1mol/L的稀硫酸与100mL0.4mol/L的NaOH溶液混合后,溶液的pH=___。
Ⅱ.工业生成尿素的原理是以NH3和CO2为原料合成尿素,反应的化学方程式为2NH3(g)+ CO2(g)![]() CO(NH2)2(1)+H2O(1),该反应的平衡常数和温度关系如下:
CO(NH2)2(1)+H2O(1),该反应的平衡常数和温度关系如下:
T/℃ | 165 | 175 | 185 | 195 |
K | 111.9 | 74.1 | 50.6 | 34.8 |
(1)ΔH___0(填“>”、“<”或“=”)。
(2)在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)n(NH3)∶n(CO2)=x,如图是氨碳比(x)与CO2平衡转化率(α)的关系,α随着x增大而增大的原因是___。
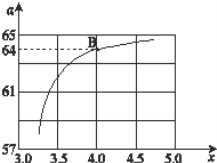
(3)图中的B点对应的NH3的平衡转化率为__。
查看答案和解析>>
科目: 来源: 题型:
【题目】对氮、碳及其化合物的研究具有重要意义。
(1)用肼![]() 为燃料,四氧化二氮做氧化剂,两者反应生成氮气和气态水。已知:
为燃料,四氧化二氮做氧化剂,两者反应生成氮气和气态水。已知:![]()
![]() ,
, ![]() ;
;![]()
![]() ,
, ![]() ;则
;则![]()
![]() ______ (用
______ (用![]() 、
、![]() 表示),该反应的化学平衡常数
表示),该反应的化学平衡常数![]() ______ (用
______ (用![]() 、
、![]() 表示)。
表示)。
(2)汽车尾气转化反应:![]() 未配平
未配平![]() ,将NO和CO转化为和
,将NO和CO转化为和![]() 和
和![]() ,实现除污,每生成
,实现除污,每生成![]() 还原剂失去电子数为 ______ 。
还原剂失去电子数为 ______ 。
(3)大气污染物氮氧化物可以用活性炭还原法处理。某研究小组向某2L的密闭容器中加入一定量的活性炭和NO,发生反应![]() 。在
。在![]() 时,反应进行到不同时间测得各物质的物质的量如下:
时,反应进行到不同时间测得各物质的物质的量如下:
0 | 10 | 20 | 30 | 40 | 50 | |
NO |
|
|
|
|
|
|
| 0 |
|
|
|
|
|
| 0 |
|
|
|
|
|
①0~10min内,NO的平均反应速率![]() ______ ;
______ ;![]() 时,该反应的平衡常数
时,该反应的平衡常数![]() ______ 。
______ 。
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 ______ ![]() 填字母编号
填字母编号![]() 。
。
a.加入一定量的活性炭 b.通入一定量的NO
c.恒容时,充入一定量的氦气 d.加入合适的催化剂
(4)氨燃料电池使用的电解质溶液是![]() 的KOH溶液,电池反应为:
的KOH溶液,电池反应为:![]() 。放电时,该电池正极的电极反应式为 ______。
。放电时,该电池正极的电极反应式为 ______。
(5)实验室中用NaOH溶液吸收![]() ,发生反应为
,发生反应为![]() 。所得混合液中所有离子浓度由大到小的顺序为 _________ 。
。所得混合液中所有离子浓度由大到小的顺序为 _________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图所示与对应叙述相符的是

A. 图甲表示一定温度下FeS和CuS的沉淀溶解平衡曲线,则Ksp(FeS)>Ksp(CuS)
B. 图乙表示pH=2的甲酸与乙酸溶液稀释时的pH变化曲线,则酸性:甲酸<乙酸
C. 图丙表示用0.1000 mol·L-lNaOH溶液滴定25.00 mL盐酸的滴定曲线,则 c(HCl)=0.0800 mol ·L-1
D. 图丁表示反应N2(g)+3H2(g) ![]() 2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列生产生活等实际应用中,不能用勒夏特列原理解释的是( )
A. 新制氯水中存在平衡Cl2+H2O ![]() HCl+ HClO,当加入AgNO3溶液后溶液颜色变浅
HCl+ HClO,当加入AgNO3溶液后溶液颜色变浅
B. 使用更有效的催化剂,提高可逆反应的转化率
C. 工业合成NH3是放热反应,为提高NH3的产率,理论上应采取低温的措施
D. 工业生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率(2SO2+O2![]() 2SO3)
2SO3)
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,用 0.1000mol·L-1 NaOH溶液滴定 20.00mL0.1000mol·L-1某一元酸HA溶液,滴定曲线如图。下列说法正确的是( )
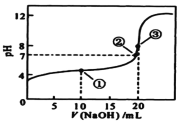
A. HA是强电解质
B. 点①所示溶液中:c(A-) >c(Na+)>c(H+) >c(OH-)
C. 点②所示溶液中:c(Na+) =c(HA) +c(A-)
D. 水的电离程度随着NaOH溶液的滴入,不断增大
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于反应热的描述中正确的是( )
A.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ba(OH)2反应生成1molH2O时会放出57.3kJ的热量
B.甲烷的燃烧热为890.3kJ·mol-1,则表示甲烷燃烧热的热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ·mol-1
C.一定条件下,将0.5molN2和l.5molH2置于密闭容器中充分反应生成NH3,放热19.3kJ,则其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H=-38.6kJ·mol-1
2NH3(g) △H=-38.6kJ·mol-1
D.若S(s)+O2(g)=SO2(g) △H1,S(g)+O2(g)=SO2(g) △H2;△H1<△H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com