
科目: 来源: 题型:
【题目】碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
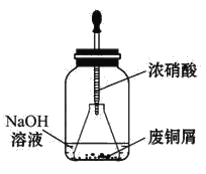
步骤一:废铜屑制硝酸铜
如图,用胶头滴管吸取浓硝酸缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液。
步骤二:碱式碳酸铜的制备
向大试管中加入碳酸钠溶液和硝酸铜溶液,水浴加热至70℃左右,用0.4 mol·L-1的NaOH溶液调节pH至8.5,振荡,静置,过滤,用热水洗涤,烘干,得到碱式碳酸铜产品。
完成下列填空:
(1)写出浓硝酸与铜反应的离子方程式_________________________________。
(2)上图装置中NaOH溶液的作用是____________________________________。
(3)步骤二中,水浴加热所需仪器有____________、____________(加热、夹持仪器、石棉网除外),水浴加热的优点是_________________________________。
(4)若实验得到2.42 g样品(只含CuO杂质),取此样品加热至分解完全后,得到1.80 g固体,此样品中碱式碳酸铜的质量分数是____。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上可用软锰矿(主要成分是MnO2)和黄铁矿(主要成分是FeS2)为主要原料制备高性能磁性材料碳酸锰(MnCO3)。其工业流程如下:

回答下列问题:
(1)为了提高溶浸工序中原料的浸出率,可以采取的措施有__________________(写一条)。
(2)除铁工序中,在加入石灰调节溶液的pH前,加入适量的软锰矿,其作用是______________。
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质。若测得滤液中c(F-)=0.01 molL-1,滤液中残留的c(Ca2+)=________________〔已知:Ksp(CaF2)=1.46×10-10〕,
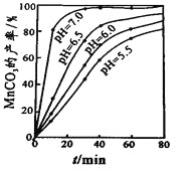
(4)沉锰工序中,298K、c(Mn2+)为1.05 molL-1时,实验测得MnCO3的产率与溶液pH、反应时间的关系如图所示。根据图中信息得出的结论是______________。
(5)沉锰工序中有CO2生成,则生成MnCO3的离子方程式是______________________。
(6)从沉锰工序中得到纯净MnCO3的操作方法是___________________。副产品A的化学式是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】用软锰矿(MnO2)、黄铁矿(FeS2)酸浸生产硫酸锰(MnSO4),并进一步制取电解二氧化锰(EMD)的工艺流程如下:
I. 将软锰矿、黄铁矿和硫酸按一定比例放入反应釜中,搅拌,加热保温反应一定时间。
II. 向反应釜中加入MnO2、CaCO3试剂,再加入Na2S溶液除掉浸出液中的重金属。
III. 过滤,向滤液中加入净化剂进一步净化,再过滤,得到精制MnSO4溶液。
IV. 将精制MnSO4溶液送入电解槽,电解制得EMD。
请回答下列问题:
(1)步骤I中搅拌、加热的目的是________。完成酸浸过程中反应的离子方程式:
![]() FeS2 +
FeS2 + ![]() MnO2 +
MnO2 + ![]() ===
=== ![]() Mn2+ +
Mn2+ +![]() Fe2+ + S + SO42-+
Fe2+ + S + SO42-+ ![]() ,_____________________
,_____________________
(2)步骤II中加入MnO2用于将浸出液中的Fe2+转化为Fe3+,该反应的离子方程式是________。加入CaCO3将浸出液pH调至pH=5,从而除掉铁,请解释用CaCO3除铁的原理:________。
(3)步骤IV中用如图所示的电解装置电解精制的MnSO4溶液,生成EMD的是________极(填“a”或“b”),生成EMD的电极反应式是_________。

(4)EMD可用作碱性锌锰电池的材料。已知碱性锌锰电池的反应式为:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2。下列关于碱性锌锰电池的说法正确的是________(填字母序号)。
A.碱性锌锰电池是二次电池
B.碱性锌锰电池将化学能转化为电能
C.正极反应为:2MnO2+2H2O+2e-=2MnOOH+2OH-
D.碱性锌锰电池工作时,电子由MnO2经外电路流向Zn极
查看答案和解析>>
科目: 来源: 题型:
【题目】次硫酸钠甲醛(xNaHSO2yHCHOzH2O)俗称吊白块,在印染、医药以及原子能工业中有广泛应用。它的组成可通过下列实验测定:①准确称取1.5400g样品,完全溶于水配成100mL溶液。②取25.00mL所配溶液经AHMT分光光度法测得甲醛物质的量浓度为0.10mol×L-1。③另取25.00mL所配溶液,加入过量碘完全反应后,加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重得到白色固体0.5825g。次硫酸氢钠和碘反应的方程式如下:xNaHSO2yHCHOzH2O+I2→NaHSO4+HI+HCHO+H2O(未配平)
(1)生成0.5825g白色固体时,需要消耗碘的质量为_____。
(2)若向吊白块溶液中加入氢氧化钠,甲醛会发生自身氧化还原反应,生成两种含氧有机物,写出该反应的离子方程式_____。
(3)通过计算确定次硫酸氢钠甲醛的组成______(写出计算过程)。
查看答案和解析>>
科目: 来源: 题型:
【题目】“低碳循环”已引起各国家的高度重视,而如何降低大气中CO2的含量和有效地开发利用CO2正成为化学家研究的主要课题。
(1)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
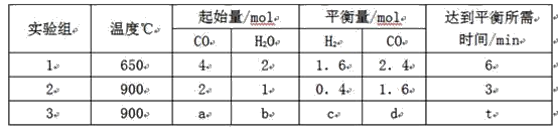
①实验2条件下平衡常数K=______________。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值_______(填具体值或取值范围)。
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时v正_________v逆(填“<”,“>”,“=”)。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH=-1275.6 kJ/mol
②2CO (g)+ O2(g) = 2CO2(g) ΔH=-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:____________
(3)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。常温下,向10 mL 0.01 mol·L-1H2C2O4溶液中滴加10mL 0.01mol·L-1NaOH溶液时,比较溶液中各种离子浓度的大小关系_____________;
(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L ,则生成沉淀所需CaCl2溶液的最小浓度为_______________mol/L。
(5)以二甲醚(CH3OCH3)、空气、H2SO4为原料,铂为电极可构成燃料电池,其工作原理与甲烷燃料电池的原理相似。请写出该电池负极上的电极反应式:__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】无水AlCl3可用作有机合成的催化剂,食品膨松剂等。已知AlCl3、FeCl3分别在183℃、315℃时升华,无水AlCl3遇潮湿空气即产生大量白雾。
I.工业上由铝土矿(主要成分是Al2O3和Fe2O3)和石油焦(主要成分是碳单质)制备无水AlCl3的流程如下:
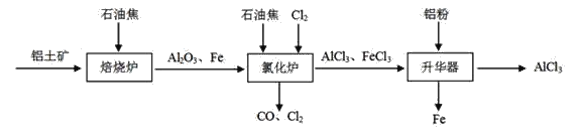
(1)焙烧炉中发生反应:①Fe2O3(s)+3C(s)![]() 2Fe(s) +3CO(g);
2Fe(s) +3CO(g);
②3CO(g)+Fe2O3(s)![]() 2Fe(s)+3CO2(g)
2Fe(s)+3CO2(g)
则反应②的平衡常数的表达式为K=_____。
(2)氯化炉中Al2O3、Cl2和C在高温下发生反应的化学方程式为_____;炉气中含有大量CO和少量Cl2,可用Na2SO3溶液除去Cl2,其离子方程式为____。
(3)精制无水AlCl3的合格品中,AlCl3的质量分数不得低于96%。现称取16.25g精制后的无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,其残留固体质量为0.16g。该样品中AlCl3的质量分数为_____。
II.实验室可用下列装置制备无水AlCl3。装置B、C中应盛放的试剂名称分别为_____、_____,F中所盛放试剂的作用是_____。
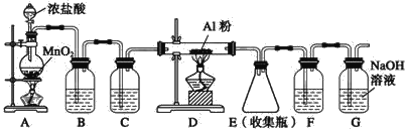
查看答案和解析>>
科目: 来源: 题型:
【题目】已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是:
A. 该溶液的pH=4 B. 升高温度,溶液的pH增大 C. 此酸的电离平衡常数约为1×10-7 D. 由HA电离出的c(H+)约为水电离出的c(H+)的106倍
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. PH=1的醋酸加水稀释到原体积的100倍,稀释后PH=3
B. 室温 pH=3的醋酸溶液和pH=11的Ba(OH)2溶液等体积混合后溶液呈酸性
C. 室温pH相同的NH4Cl溶液和CH3COOH溶液,由水电离产生的c(H+)相同
D. 某温度下,水的离子积常数为1×10-12,该温度下PH=7的溶液呈中性
查看答案和解析>>
科目: 来源: 题型:
【题目】我国对“可呼吸”的钠——二氧化碳电池的研究取得突破性进展。该电池的总反应式为4Na+3CO2![]() 2Na2CO3+C,其工作原理如图所示(放电时产生的Na2CO3固体贮存于碳纳米管中)。
2Na2CO3+C,其工作原理如图所示(放电时产生的Na2CO3固体贮存于碳纳米管中)。
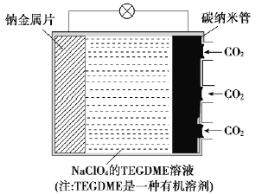
(1)钠金属片作为该电池的___极(填“正”或“负”,下同);放电时,电解质溶液中Na+从___极区向___极区移动。
(2)充电时,碳纳米管连接直流电源的___极,电极反应式为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】乙烯是一种重要的化工原料,可由乙烷为原料制取。请回答下列问题:
(1)传统的热裂解法和现代的氧化裂解法的热化学方程式如下:
C2H6(g)=C2H4(g)+H2(g) ΔH1=+136kJ·mol-1
C2H6(g)+![]() O2(g)=C2H4(g)+H2O(g) ΔH2=-110kJ·mol-1
O2(g)=C2H4(g)+H2O(g) ΔH2=-110kJ·mol-1
已知水的汽化热为H2O(l)=H2O(g) ΔH3=+44kJ·mol-1
且反应相关的部分化学键键能数据如下:
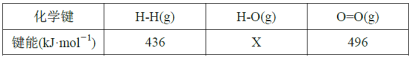
①由此计算x=___,通过比较ΔH1和ΔH2,说明氧化裂解法中通入氧气的作用是___。
②其他条件相同,对于氧化裂化法制乙烯的反应中,实验测得在T1和P1与T2和P2条件下该反应的C2H6平衡转化率相同,若T1>T2,则P1___P2(填“>”、“<”或“=”)。
③请求出下列反应的反应热:C2H6(g)+![]() O2(g)=C2H4(g)+H2O(l) ΔH3=___。
O2(g)=C2H4(g)+H2O(l) ΔH3=___。
(2)一定条件下,在体积为2L的密闭容器中,充入1molC2H6发生传统裂解法制乙烯。
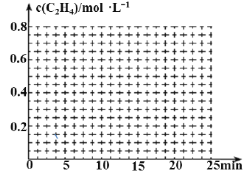
①某温度下,10min后该反应达平衡,此时C2H6的物质的量浓度为0.2mol·L-1,从反应开始到平衡,乙烯的平均反应速率v(C2H4)=___。
②在其它条件不变的情况下,15min时升高体系温度,20min达到新平衡,请在下边的坐标系中画出0~25 min,c(C2H4)随时间变化曲线:____。
(3)乙烷的氧化裂解反应产物中除了C2H4外,还存在CH4、CO、CO2等副产物(副反应均为放热反应),图1为温度对乙烷氧化裂解反应性能的影响。乙烷的转化率随温度的升高而升高的原因是___;反应的最佳温度为___(填选项序号)。
A.700℃ B.750℃ C.850℃ D.900℃
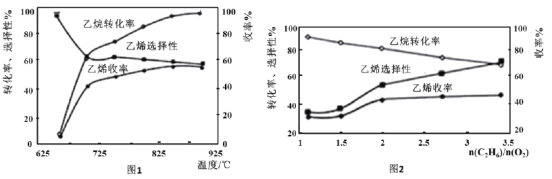
[乙烯选择性=![]() ;乙烯收率=乙烷转化率×乙烯选择性]
;乙烯收率=乙烷转化率×乙烯选择性]
(4)烃类氧化反应中,氧气含量低会导致反应产生积炭,堵塞反应管。图2为n(C2H6)/n(O2)的值对乙烷氧化裂解反应性能的影响。判断乙烷氧化裂解过程中![]() 的最佳值是___;判断的理由是___。
的最佳值是___;判断的理由是___。
(5)工业上,保持体系总压恒定为100kPa的条件下进行该反应,通常在乙烷和氧气的混合气体中掺混惰性气体(惰性气体的体积分数为70%),掺混惰性气体的目的是___。
(6)反应达平衡时,各组分的体积分数如下表:
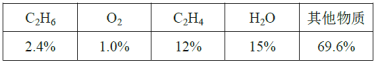
计算该温度下的平衡常数Kp=___(用平衡分压代替平衡浓度,平衡分压=总压×体积分数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com