
科目: 来源: 题型:
【题目】氢能将成为21世纪的主要能源。太阳能光伏电池电解水可制高纯氢,工作示意图如下。通过控制开关连接K1或K2,可交替得到H2和O2。
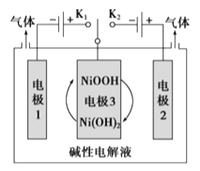
(1)制H2时,连接________(填“K1”或“K2”),产生H2的电极反应式是____________,溶液pH___________(填“增大”、“减小”或“不变”)。
(2)改变开关连接方式,可得O2,此时电极3的反应式为:__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题。
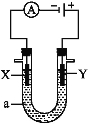
若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞溶液,则:
(1)电解池中X极上的电极反应式是 ,在X极附近观察到的现象是 。
(2)Y电极上的电极反应式是 ,检验该电极反应产物的方法是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】图中甲池的总反应式为![]() 。
。
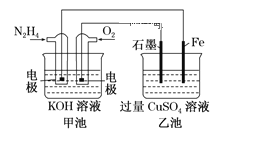
(1)甲池中负极上的电极反应式为_____________________。
(2)乙池中石墨电极上电极反应式为_________________________________。
(3)要使乙池恢复到电解前的状态,应向溶液中加入适量的 _______________。
A.CuO B.Cu(OH)2 C.CuCO3 D.CuSO4
(4)若将乙池中两个电极改成等质量的Fe和Cu,实现在Fe上镀Cu,当甲中消耗1.6gN2H4时,乙池中两个电极质量差为_________________g。
查看答案和解析>>
科目: 来源: 题型:
【题目】硒(Se)和碲(Te)有许多优良性能,被广泛用于冶金、化工、医药卫生等领域。工业上以铜阳极泥(含有Cu、Cu2S、Cu2Se、Cu2Te等)为原料制备硒和碲的一种生产工艺如下图所示:
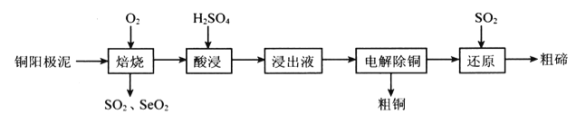
已知:“酸浸”过程中TeO2与硫酸反应生成TeOSO4。
(1)焙烧时通入氧气使铜阳极泥沸腾,目的是________________。
(2)SeO2与SO2的混合烟气可用水吸收制得单质Se,该反应中氧化产物与还原产物的物质的量之比为_____________。已知25℃时,亚硒酸(H2SeO3)的Ka1=2.5×10-3,Ka2=2.6×10-7,NaHSeO3溶液的pH________7(填“>”、“<”或“=”),理由是____________________。
(3)“浸出液”的溶质成分除了TeOSO4外,还有_______________。上述整个流程中可以循环使用的物质是___________________。
(4)“还原”步骤中生成Te的化学方程式为_______________________;Te也可以通过碱性环境下电解Na2TeO3溶液获得,其阴极的电极反应式为___________________。
(5)粗硒中硒的含量可用如下方法测定:
①Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O;
②SeO2+4KI+4HNO3=Se+2I2+4KNO3+2H2O;
③I2+2Na2S2O3=Na2S4O6+2NaI
通过用Na2S2O3标准溶液滴定反应②中生成的I2来计算硒的含量。实验中准确称量0.1200 g粗硒样品,滴定中消耗0.2000 mol·L-1Na2S2O3溶液24.00 mL,则粗硒样品中硒的质量分数为_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,将浓度均为0.1molL、体积分别为Va和Vb的HX溶液与NH3·H2O溶液按不同体积比混合,保持Va+Vb=100mL,Va、Vb与混合液的pH的关系如图所示。下列说法正确的是( )

A. Ka(HX)>Kb(NH3·H2O)
B. b点时c(NH4+)>c(HX)>c(OH—)=c(H+)
C. a、b、d几点中,水的电离程度d>b>a
D. a →b点过程中,可能存在c(X—)<c(NH4+)
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)写出![]() 中官能团的名称为_________________;
中官能团的名称为_________________;
(2)![]() 的分子式为_____________,1 mol该有机物完全燃烧需消耗氧气的物质的量为________mol,分子中一定共面的原子有________个;
的分子式为_____________,1 mol该有机物完全燃烧需消耗氧气的物质的量为________mol,分子中一定共面的原子有________个;
(3)有机物M(![]() )为苯的同分异构体,M的二氯代物的同分异构体有____种;
)为苯的同分异构体,M的二氯代物的同分异构体有____种;
(4)用系统命名法对下列有机物进行命名:
① CH3C(CH3)=CHCH3:______________;
② CH3CH(CH2CH3)CH(CH3)CH2CH3:_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】空气中含有吸入颗粒物PM2.5,严重影响人的生理和健康,因此改善发质结构、机动车辆措施能有效减少PM2.5、SO2、NO3等的污染。请回答下列问题:
(1)将一定量的某PM2.5样品用蒸馏水溶解制成待测试样(忽略OH-)。常温下,测得该试样的组成及其浓度如下表:
离子 | K+ | Na+ | NH4+ | SO42- | NO3﹣ | Cl﹣ |
浓度/mol·L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断,该试样的pH = ________。
(2)汽车尾气中NOx和CO的生成。已知:气缸中生成NO的反应为N2(g)+O2(g)![]() 2NO(g) △H>0。恒温,恒容密闭容器中,下列叙述,能说明该反应达到化学平衡状态的是________ (填序号)。
2NO(g) △H>0。恒温,恒容密闭容器中,下列叙述,能说明该反应达到化学平衡状态的是________ (填序号)。
A.混合气体的密度不再变化 B.混合气体的平均分子质量不再变化
C.N2、O2、NO的物质的量之比为1:1:2 D.氧气的转化率不再变化
E.生成lmol N2的间时有lmol O2被消耗
(3)为减少CO2、SO2的排放,常采取的措施如下:
①将煤转化为淸洁气体燃料。己知:H2(g)+1/2O2(g)= H2O(g) △H =-241.8kJ mol-1; C(s)+1/2O2(g)=CO(g) △H =-110.5kJ mol-1。写出焦炭与水蒸气反应的热化学方程式:_____________________________________。
②洗涤含SO2的烟气。下列物质,可作为洗涤含SO2烟气的洗涤剂的是______(填序号)。
A.浓氨水 B.碳酸氢钠饱和溶液 C.FeCl3饱和溶液 D.酸性CaCl2饱和溶液
(4)某湿度下,反应2NO(g)+O2(g) ![]() 2NO2(g)中,在保证O2浓度不变的情况下,增大容器的体积, 平衡将_____(填“正反应方向” “逆反应方向”或“不”)移动。
2NO2(g)中,在保证O2浓度不变的情况下,增大容器的体积, 平衡将_____(填“正反应方向” “逆反应方向”或“不”)移动。
判断的依据是__________________________________。
(5)甲醇燃料电池可能成为未来便携电子产品应用的主流。某种甲醇燃料电池的工作原理如图14所示,则通入a气体的电极,电极反应式为_________________。

(6)—定条件下,甲醇与一氧化碳反应可以合成乙酸。常温条件下,将a mol/L的CH3COOH溶液与bmol/LBa(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示,该混合溶液中醋酸的电离常数为___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在25mL 0.1mol·L-1NaOH溶液中逐滴加入0.2mol·L-1CH3COOH溶液,溶液pH变化曲线如图所示,下列有关离子浓度的比较正确的是

A.在A、B间任一点(不含A、B点),溶液中可能有c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.在C点,c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D.在D点,c(CH3COO-)+c(CH3COOH)=c(Na+)
查看答案和解析>>
科目: 来源: 题型:
【题目】在t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t ℃时AgCl的Ksp=4×10-10 mol2·L-2,下列说法不正确的是

A.在t ℃时,AgBr的Ksp为4.9×10-13 mol2·L-2
B.在AgBr饱和溶液中加入NaBr固体,可使溶液由b点到c点
C.图中a点对应的是AgBr的不饱和溶液
D.在t ℃时,AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)的平衡常数K≈816
AgBr(s)+Cl-(aq)的平衡常数K≈816
查看答案和解析>>
科目: 来源: 题型:
【题目】 lmol碳完全燃烧后可放出393.5KJ的热量,下列热化学方程式正确的是( )
A.C(s)+O2(g)=CO2(g) △H=+393.5kJ/mol
B.C(s)+![]() O2(g)=CO(g) △H=﹣393.5kJ/mol
O2(g)=CO(g) △H=﹣393.5kJ/mol
C.C+O2=CO2 △H=﹣393.5kJ/mol
D.C(s)+O2(g)=CO2(g) △H=﹣393.5kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com