
科目: 来源: 题型:
【题目】下列有关同分异构体数目的叙述不正确的是
A.若甲苯苯环上的一个氢原子被一个含3个碳原子的烷基取代,所得产物有6种
B.(CH3)2CHCl在浓硫酸作用下发生消去反应只得到一种烯烃
C.含有5个碳原子的饱和链烃,其一氯取代物共有8种
D.与![]() 互为同分异构体的芳香族化合物有6种
互为同分异构体的芳香族化合物有6种
查看答案和解析>>
科目: 来源: 题型:
【题目】电解法处理酸性含铬废水(主要含有![]() )时,以铁板作阴、阳极,处理过程中存在反应
)时,以铁板作阴、阳极,处理过程中存在反应![]() +6Fe2++14H+=2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去。下列说法不正确的是 ( )
+6Fe2++14H+=2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去。下列说法不正确的是 ( )
A.阳极反应为Fe-2e-=Fe2+
B.电解过程中溶液c(H+)不会变化
C.处理过程中有Fe(OH)3沉淀生成
D.电路中每转移12 mol电子,最多有1 mol![]() 被还原
被还原
查看答案和解析>>
科目: 来源: 题型:
【题目】两种气态烃以任意比例混合,在120℃,常压下,取1L该混合烃在3.5L氧气中完全燃烧,恢复到原状态,测得气体体积为4.5L,则符合该条件的烃的组合是
A.CH4、C3H6B.CH4、C2H4C.C2H4、C3H8D.C2H2、C3H6
查看答案和解析>>
科目: 来源: 题型:
【题目】贮氢合金![]() 可催化由CO、
可催化由CO、![]() 合成
合成![]() 等有机化工产品的反应。温度为TK时发生以下反应:
等有机化工产品的反应。温度为TK时发生以下反应:
①![]()
![]()
②![]()
![]()
③![]()
④![]()
(1)温度为TK时,催化由CO、![]() 合成
合成![]() 反应的热化学方程式为________。
反应的热化学方程式为________。
(2)已知温度为TK时![]() 的活化能为
的活化能为![]() ,则其逆反应的活化能为________
,则其逆反应的活化能为________![]() 。
。
(3)![]() 时,向一恒压密闭容器中充入等物质的量的
时,向一恒压密闭容器中充入等物质的量的![]() 和
和![]() 发生上述反应②
发生上述反应②![]() 已排除其他反应干扰
已排除其他反应干扰![]() ,测得
,测得![]() 物质的量分数随时间变化如下表所示:
物质的量分数随时间变化如下表所示:
时间 | 0 | 2 | 5 | 6 | 9 | 10 |
|
|
|
|
|
|
|
若初始投入CO为![]() ,恒压容器容积
,恒压容器容积![]() ,用
,用![]() 表示该反应
表示该反应![]() 分钟内的速率
分钟内的速率![]() ________。6分钟时,仅改变一种条件破坏了平衡,则改变的外界条件为________。
________。6分钟时,仅改变一种条件破坏了平衡,则改变的外界条件为________。
(4)![]() 下,在恒容密闭容器中,充入一定量的甲醇,发生反应④,若起始压强为
下,在恒容密闭容器中,充入一定量的甲醇,发生反应④,若起始压强为![]() ,达到平衡转化率为
,达到平衡转化率为![]() ,则反应的平衡常数
,则反应的平衡常数![]() ________
________![]() 用平衡分压代替平衡浓度计算,分压
用平衡分压代替平衡浓度计算,分压![]() 总压
总压![]() 物质的量分数,忽略其它反应
物质的量分数,忽略其它反应![]() 。
。
(5)某温度下,将![]() 与
与![]() 的混合气体充入容积为
的混合气体充入容积为![]() 的密闭容器中,在催化剂的作用下发生反应③。经过
的密闭容器中,在催化剂的作用下发生反应③。经过![]() 后,反应达到平衡,此时转移电子
后,反应达到平衡,此时转移电子![]() 。若保持体积不变,再充入
。若保持体积不变,再充入![]() 和
和![]() ,此时
,此时![]() ________
________![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。下列不能说明该反应已达到平衡状态的是________。
。下列不能说明该反应已达到平衡状态的是________。
![]() 的质量不变
的质量不变 ![]() 混合气体的平均相对分子质量不再改变
混合气体的平均相对分子质量不再改变
![]()
![]() 混合气体的密度不再发生改变
混合气体的密度不再发生改变
(6)已知![]() 、
、![]() 时水煤气变换中CO和
时水煤气变换中CO和![]() 分压随时间变化关系如下图所示,催化剂为氧化铁。实验初始时体系中的
分压随时间变化关系如下图所示,催化剂为氧化铁。实验初始时体系中的![]() 和
和![]() 相等、
相等、![]() 和
和![]() 相等;已知
相等;已知![]() 时
时![]() 的
的![]() 。
。

![]() 时
时![]() 随时间变化关系的曲线是________,
随时间变化关系的曲线是________,![]() 时
时![]() 随时间变化关系的曲线是________。
随时间变化关系的曲线是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】银制器皿表面日久因生成Ag2S而变黑,可进行如下处理:将表面发黑的银器浸入盛有食盐水的铝质容器中(如图),一段时间后黑色褪去。有关说法正确的是( )

A.该处理过程中电能转化为化学能
B.银器为正极,Ag2S还原为单质银
C.Ag2S溶解于食盐水生成了AgCl
D.铝质容器质量增加
查看答案和解析>>
科目: 来源: 题型:
【题目】在K2Cr2O7溶液中存在下列平衡:2CrO42—(黄色)+2H+![]() Cr2O72—(橙色)+H2O中,溶液颜色介于黄色和橙色之间,今欲使溶液颜色变成黄色,根据勒夏特列原理可以在溶液中加入( )
Cr2O72—(橙色)+H2O中,溶液颜色介于黄色和橙色之间,今欲使溶液颜色变成黄色,根据勒夏特列原理可以在溶液中加入( )
①H+ ②OH- ③K+ ④H2O
A.①③B.②④C.①④D.②③
查看答案和解析>>
科目: 来源: 题型:
【题目】从葡萄籽中提取的原花青素结构如图,具有生物活性,如抗氧化和自由基清除能力等。有关原花青素的下列说法不正确的是

A. 该物质可以看作醇类,也可看做酚类
B. 1 mol该物质可与4 mol Br2反应
C. 1 mol该物质可与7 mol NaOH反应
D. 1 mol该物质可与7 mol Na反应
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:①2H2(g)+O2(g)===2H2O(l) ΔH=-570.0 kJ·mol-1;②CO(g)+![]() O2(g)===CO2(g) ΔH=-280 kJ·mol-1。某H2和CO的混合气体完全燃烧放出141 kJ热量,同时消耗标准状况下5.6 L O2,则原混合气体中H2和CO的物质的量之比为( )
O2(g)===CO2(g) ΔH=-280 kJ·mol-1。某H2和CO的混合气体完全燃烧放出141 kJ热量,同时消耗标准状况下5.6 L O2,则原混合气体中H2和CO的物质的量之比为( )
A.2∶1B.1∶2C.1∶1D.2∶3
查看答案和解析>>
科目: 来源: 题型:
【题目】氨在生产生活中应用广泛。
(1) NH2Cl与水反应生成强氧化性的物质,可作长效缓释消毒剂,工业上可通过反应:NH3(g)+Cl2(g)=NH2Cl(g) + HCl(g)制备氯胺,已知部分化学键的键能如下表所示(假定不同物质中同种化学键的键能一样), 则上述反应的H=__________kJ·mol—1
化学键 | N-H | Cl-Cl | N-Cl | H-Cl |
键能/(kJ/mol) | a | b | c | d |
(2)氨气是重要的化工产品。目前工业合成氨的原理是: N2(g)+3H2(g) ![]() 2NH3(g)。在恒温恒压装置中进行工业合成氨反应,下列说法正确的是__________。
2NH3(g)。在恒温恒压装置中进行工业合成氨反应,下列说法正确的是__________。
a.气体压强不再变化时,表明该反应已达平衡状态
b.气体密度不再变化时,表明该反应已达平衡状态
c.平衡后,压缩容器,会生成更多NH3
d.平衡后,向装置中通入一定量Ar, 平衡不移动
(3)现向三个体积均为5L,温度分别恒定为T1、 T2、T3的恒容密闭容器I、II、 III中,分别充入1 mol N2和3 molH2发生反应: N2(g)+3H2(g) ![]() 2NH3(g) H1=-93 kJ·mol—1,当反应均进行到2min时H2的体积分数如图所示,其中只有一个容器中的反应已经达到平衡状态。
2NH3(g) H1=-93 kJ·mol—1,当反应均进行到2min时H2的体积分数如图所示,其中只有一个容器中的反应已经达到平衡状态。
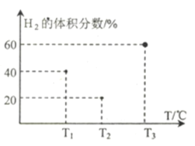
①2min时三个容器中的反应达到化学平衡状态的是_____容器.(填“I”、“II”或“III”)。
②0~2 min内容器I中用NH3表示的化学反应速率v(NH3)=____。 (保留两位有效数字)
③2 min时容器II中v正______ v逆。 (填“<”、 “>”或“=”)
④当三个容器中的反应均达到平衡状态时,平衡常数最小的是容器______(填容器序号),它的数值为____(保留两位有效数字)。
(4)氨在高温下可将一些固体金属氧化物还原为固态或液态金属单质,本身被氧化为N2。在不同温度下,氨气还原四种金属氧化物达到平衡后,气体中![]() 与温度(T)的关系如图所示。下列说法正确的是______(填字母)。
与温度(T)的关系如图所示。下列说法正确的是______(填字母)。

A. NH3还原PbO2的反应△H>0
B.工业冶炼这四种金属时,NH3冶炼金属铬(Cr)的还原效率最低
C.实验室还原出金属铜(Cu)时,325°C 下NH3的利用率比425°C下NH3的利用率更大
D.通过延长反应管的长度来增加金属氧化物和NH3的接触面积,可以减少尾气中NH3的量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com