
科目: 来源: 题型:
【题目】Ⅰ.有机物A的质谱图和红外光谱图分别如下:
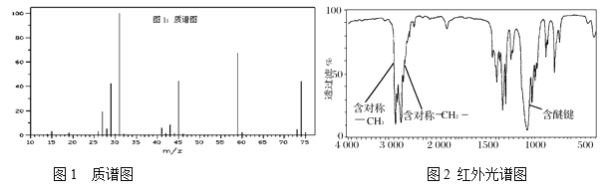
(1)A的结构简式为________。
Ⅱ.相对分子质量不超过100的有机物B,既能与金属钠反应产生无色气体,又能与碳酸钠反应产生无色气体,还可以使溴的四氯化碳溶液褪色。B完全燃烧只生成CO2和H2O。经分析其含氧元素的质量分数为37.21%。经核磁共振检测发现B的氢谱如图:

(2)B的结构简式为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有 关汉黄芩素的叙述正确的是
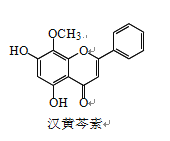
A. 汉黄芩素的分子式为 C16H13O5
B. 该物质遇 FeCl3 溶液显色
C. 1 mol 该物质与溴水反应,最多消耗 1 mol Br2
D. 与足量 H2 发生加成反应后,该分子中官能团的种类减少 1 种
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关系正确的是()
A.熔点:正戊烷>2,2-二甲基戊烷>2,3-二甲基丁烷>丙烷
B.密度:CCl4>H2O>苯
C.同质量的物质燃烧耗O2量:乙烷>乙烯>乙炔>甲烷
D.同物质的量物质燃烧耗O2量:环已烷>苯>苯甲酸
查看答案和解析>>
科目: 来源: 题型:
【题目】碘化锂(![]() )在能源、医药等领域有重要应用,某兴趣小组制备
)在能源、医药等领域有重要应用,某兴趣小组制备![]() 和
和![]() ,流程如下:
,流程如下:
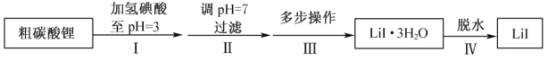
已知:![]() 在75~80℃转变成
在75~80℃转变成![]() ,80~120℃转变成
,80~120℃转变成![]() ,300℃以上转变成无水
,300℃以上转变成无水![]() 。
。
b.![]() 易溶于水,溶解度随温度升高而增大。
易溶于水,溶解度随温度升高而增大。
c.![]() 在空气中受热易被氧化。
在空气中受热易被氧化。
请回答:
(1)步骤II,调![]() ,为避免引入新的杂质,适宜加入的试剂为________。
,为避免引入新的杂质,适宜加入的试剂为________。
(2)步骤III,包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥等多步操作。
下列说法正确的是________。
A.为得到较大的![]() 晶体颗粒,宜用冰水浴快速冷却结晶
晶体颗粒,宜用冰水浴快速冷却结晶
B.为加快过滤速度,得到较干燥的晶体,可进行抽滤
C.宜用热水洗涤
D.可在80℃鼓风干燥
(3)步骤IV,脱水方案为:将所得![]() 置入坩埚中,300℃加热,得
置入坩埚中,300℃加热,得![]() 样品。用沉淀滴定法分别测定所得
样品。用沉淀滴定法分别测定所得![]() 、
、![]() 样品纯度,测定过程如下:称取一定量样品,溶解,定容于容量瓶,将容量瓶中的溶液倒入烧杯,用移液管定量移取烧杯中的溶液加入锥形瓶,调
样品纯度,测定过程如下:称取一定量样品,溶解,定容于容量瓶,将容量瓶中的溶液倒入烧杯,用移液管定量移取烧杯中的溶液加入锥形瓶,调![]() ,用滴定管中的
,用滴定管中的![]() 标准溶液滴定至终点,根据消耗的
标准溶液滴定至终点,根据消耗的![]() 标准溶液体积计算,得
标准溶液体积计算,得![]() 、
、![]() 的纯度分别为99.96%,95.38%。
的纯度分别为99.96%,95.38%。![]() 纯度偏低。
纯度偏低。
①上述测定过程提及的下列仪器,在使用前一定不能润洗的是________。
A.容量瓶 B.烧杯 C.锥形瓶 D.滴定管
②测定过程中使用到移液管,选出其正确操作并按序列出字母:
蒸馏水洗涤→待转移溶液润洗→________→_______→_______→_______→洗净,放回管架。
a.移液管尖与锥形瓶内壁接触,边吹气边放液
b.放液完毕,停留数秒,取出移液管
c.移液管尖与锥形瓶内壁接触,松开食指放液设备
d.洗耳球吸溶液至移液管标线以上,食指堵住管口
e.放液完毕,抖动数下,取出移液管
f.放液至凹液面最低处与移液管标线相切,按紧管口
③![]() 纯度偏低,可能的主要杂质是________。
纯度偏低,可能的主要杂质是________。

(4)步骤IV,采用改进的实验方案(装置如图),可以提高![]() 纯度。
纯度。
①设备X的名称是________。
②请说明采用该方案可以提高![]() 纯度的理由________。
纯度的理由________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备。工艺流程如下:
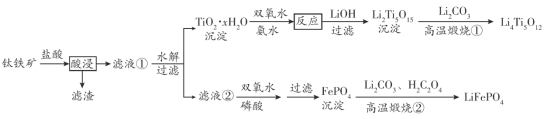
“酸浸”后,钛主要以![]() 形式存在,若“滤液②”中c(Mg2+)=0.02 mol ·L-1,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×10-5mol·L-1,此时是否有Mg3(PO4)2沉淀生成? 已知FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-2 _____________(列式计算)。
形式存在,若“滤液②”中c(Mg2+)=0.02 mol ·L-1,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×10-5mol·L-1,此时是否有Mg3(PO4)2沉淀生成? 已知FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-2 _____________(列式计算)。
查看答案和解析>>
科目: 来源: 题型:
【题目】醇与氢卤酸反应是制备卤代烃的重要方法。已知:溴乙烷及1-溴丁烷均难溶于水且二者在氢氧化钠作用下会发生水解反应。实验室制备溴乙烷和 1溴丁烷的反应如下:
NaBr+H2SO 4 =HBr+NaHSO4 ①
R—OH+HBr→ R—Br+H2O②
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br- 被浓硫酸氧化为 Br2等。有关数据列表如下:
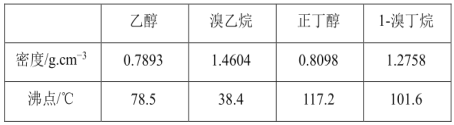
请回答下列问题:
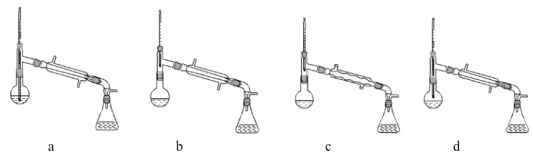
(1)在蒸馏过程中,仪器选择及安装都正确的是____________(填标号)。
(2)醇的水溶性______(填“大于”、“等于”或“小于”)相应的溴代烃。
(3)将 1溴丁烷粗产品置于分液漏斗中加水,振荡后静置,水在________(填“上层”“下层”或“不分层”)。
(4)制备操作中,加入的浓硫酸必须进行稀释,其目的是________(填字母)。
a.水是反应的催化剂 b.减少 Br2 的生成
c.减少 HBr 的挥发 d.减少副产物烯和醚的生成
(5)欲除去溴乙烷中的少量杂质 Br 2 ,下列物质中最适合的是________(填字母)。
a.NaI b.KCl c.NaOH d.NaHSO 3
(6)在制备溴乙烷时,采用边反应边蒸出产物的方法,其有利于_______;但在制备 1溴丁烷时却不能边反应边蒸出产物,其原因是________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)相同条件下,0.1 mol·L-1NH4Al(SO4)2溶液中c((NH4+)_________(填“等于”、“大于”或“小于”) 0.1 mol·L-1NH4HSO4溶液中c(NH4+)
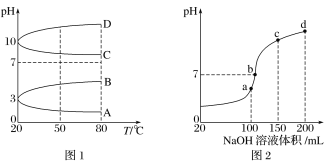
(2)如图1是0.1 mol·L-1电解质溶液的pH随温度变化的图像。
①其中符合0.1 mol·L-1NH4Al(SO4)2溶液的pH随温度变化的曲线是______(填字母)。
②室温时,0.1 mol·L-1NH4Al(SO4)2溶液中2c(SO42-)- c(NH4+)-3c(Al3+)=________ mol·L-1
(3)室温时,向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示。 试分析图中a、b、c、d四个点,水的电离程度最大的是____________; 在b点,溶液中各离子浓度由大到小的排列顺序是___________________。
(4)用0.1mol/LNaOH溶液滴定盐酸溶液,下列操作中使结果偏高的是___________________
A.盛标准溶液的滴定管用蒸馏水洗涤后未用标准液润洗就装液滴定
B.锥形瓶用蒸馏水洗涤后未用待测液润洗
C.读取标准液读数时,滴定前平视,滴定到终点后俯视
D.滴定前盛标准液的滴定管尖嘴处有气泡未排除,滴定后气泡消失
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D是四种常见的有机物,其中A的产量通常用来衡量一个国家的石油化工发展水平,B与C在浓硫酸和加热条件下发生反应,生成的有机物有特殊香味;A、B、C、D在一定条件下的转化关系如图所示(反应条件已省略):

(1)B的结构简式为______________,C中官能团的名称为__________。
(2)丙烯酸(CH2=CH-COOH)的性质可能有_______________。(多选)
A.加成反应 B.取代反应 C.中和反应 D.氧化反应
(3)用一种方法鉴别B和C,所用试剂是___________________。
(4)丙烯酸乙酯的结构简式为_______________。
(5)写出下列反应方程式和有机反应基本类型:
③___________________________,___________反应;
⑤___________________________,___________ 反应。
查看答案和解析>>
科目: 来源: 题型:
【题目】海水是一个巨大的化学资源宝库,利用海水可以获得很多化工产品。
(1)海水淡化的方法有蒸馏法、________________________(填1种方法)。
(2)海水中制得的饱和氯化钠溶液可以利用电解法直接制取次氯酸钠,制取的离子方程式为____。
(3)利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去):

将Br2与Na2CO3反应的化学方程式补充完整:
___Br2+___Na2CO3===___NaBrO3+___ ________+___ ________
(4)盐卤蒸发冷却后析出卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+、Mn2+等离子。以卤块为原料制得镁的工艺流程如下(部分操作和条件已略去):

已知:常温下0.010 mol·L-1金属离子在不同pH下的沉淀情况如下:
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH)2 | 9.6 | 11.1 |
①步骤②中需控制pH=9.8,其目的是_____________。
②NaClO还能除去盐卤中的CO(NH2)2,生成盐和一种能参与大气循环的物质。除去0.2 mol CO(NH2)2时消耗NaClO ________g。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室以绿矾(FeSO4·7H2O)制备补血剂甘氨酸亚铁[(NH2CH2COO)2Fe] 有关物质性质如下:
甘氨酸(NH2CH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇,两性化合物 | 易溶于水和乙醇,有强酸性和还原性 | 易溶于水,难溶于乙醇 |
实验过程:
Ⅰ.配制含0.10mol FeSO4的绿矾溶液。
Ⅱ.制备FeCO3:向配制好的绿矾溶液中,缓慢加入200mL 1.1mol·L-1NH4HCO3溶液,边加边搅拌,反应结束后过滤并洗涤沉淀。
Ⅲ.制备(NH2CH2COO)2Fe:实验装置如下图(夹持和加热仪器已省略),将实验Ⅱ得到的沉淀和含0.20 mol甘氨酸的水溶液混合后加入C中,然后利用A中的反应将C中空气排净,接着滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥得到产品。
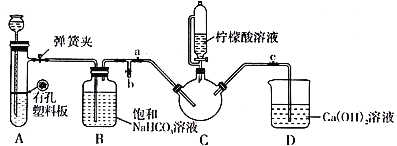
回答下列问题:
(1)实验I中:实验室配制绿矾溶液时,为防止FeSO4被氧化变质,应加入的试剂为_______(写化学式)。再滴加少量稀硫酸的作用是__________________________。
(2)实验II中:生成沉淀的离子方程式为__________________________。
(3)实验Ⅲ中:①C中盛柠檬酸溶液的仪器名称为___________________。
②装置A中所盛放的药品是___________________。(填序号)
A.Na2CO3和稀H2SO4 B.CaCO3和稀H2SO4 C.CaCO3和稀盐酸
③确认C中空气排尽的实验现象是____________________。
④加入柠檬酸溶液一方面可调节溶液的pH促进FeCO3溶解,另一个作用是________________。
⑤洗涤实验Ⅲ中得到的沉淀,所选用的最佳洗涤试剂是___________________。(填序号)
A.热水 B.乙醇溶液 C.柠檬酸溶液
⑥若产品的质量为17.34g,则产率为________%。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com