
科目: 来源: 题型:
【题目】海洋资源的开发与利用具有广阔的前景。海水的pH一般在7.5~8.6之间。某地海水中主要离子的含量如下表:
成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
含量/mgL-1 | 9360 | 83 | 160 | 1100 | 16000 | 1200 | 118 |
(1)海水显弱碱性的原因是(用离子方程式表示):____________,该海水中Ca2+的物质的量浓度为__________mol/L 。
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如下图所示。其中阴(阳)离子交换膜只允许阴(阳)离子通过,电极均为惰性电极。

① 开始时阳极的电极反应式为________________。
② 电解一段时间,____极(填“阴”或“阳”)会产生水垢,其成份为_____(填化学式)。
③ 淡水的出口为a、b、c中的__________出口。
(3)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料,如LiFePO4电池某电极的工作原理如图所示:

该电池电解质为能传导 Li+的固体材料。
上面左图中的小黑点表示_____(填粒子符号),充电时该电极反应式为_______。
(4)利用海洋资源可获得MnO2 。MnO2可用来制备高锰酸钾:将MnO2与KOH混合后在空气中加热熔融,得到绿色的锰酸钾(K2MnO4),再利用氯气将锰酸钾氧化成高锰酸钾。该制备过程中消耗相同条件下氯气和空气的体积比为_________(空气中氧气的体积分数按20%计)。
查看答案和解析>>
科目: 来源: 题型:
【题目】三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料,在催化剂作用下可发生反应:2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g),在50 ℃和70 ℃ K时SiHCl3的转化率随时间变化的结果如图所示。
SiH2Cl2(g)+SiCl4(g),在50 ℃和70 ℃ K时SiHCl3的转化率随时间变化的结果如图所示。
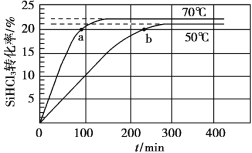
下列叙述不正确的是
A.该反应为吸热反应
B.反应速率大小:va >vb
C.70 ℃时,平衡常数K =0.112/0.782
D.增大压强,可以提高SiHCl3的平衡转化率,缩短达平衡的时间
查看答案和解析>>
科目: 来源: 题型:
【题目】常温时,向20mL 0.1 mol/L的CH3COOH溶液中逐滴滴加0.1 mol/L的NaOH溶液,滴入NaOH溶液的体积与溶液pH的变化如图所示。下列说法正确的是
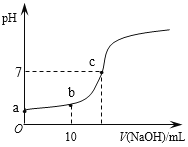
A. a点的pH=1
B. b点时,c (CH3COO—)=0.05mol/L
C. c点时,V(NaOH)=20mL
D. 反应过程中![]() 的值不断增大
的值不断增大
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,将pH和体积均相同的HCl和CH3COOH溶液分别加水稀释,其pH随加水体积的变化如图所示。下列叙述正确的是
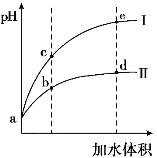
A.曲线II代表HCl的稀释过程
B.溶液中水的电离程度:b点>c点
C.从b点到d点,溶液中![]() 保持不变
保持不变
D.该温度下,b点Kw的数值比e点大
查看答案和解析>>
科目: 来源: 题型:
【题目】偏二甲肼[(CH3)2N—NH2]与N2O4是常用的火箭推进剂,火箭发射时常出现红棕色气体,发生的化学反应如下:
① (CH3)2N—NH2(l) + 2N2O4(l) = 2CO2(g) + 3N2(g) + 4H2O(g) H1<0
② N2O4(l) ![]() 2NO2(g) H2 >0
2NO2(g) H2 >0
下列说法不正确的是
A.反应①中,N2O4为氧化剂
B.反应①中,生成1mol CO2时,转移8 mol e-
C.由反应②推断:加压、降温是获得液态N2O4的条件
D.温度升高,反应①的化学反应速率减小、反应②的化学反应速率增大
查看答案和解析>>
科目: 来源: 题型:
【题目】钴的化合物在工业生产、生命科技等行业有重要应用。
(1)Co2+的核外电子排布式为___,Co的第四电离能比Fe的第四电离能要小得多,原因是___。
(2)Fe、Co均能与CO形成配合物,如Fe(CO)5、Co2(CO)8的结构如图1、图2所示,图1中1molFe(CO)5含有__mol配位键,图2中C原子的杂化方式为___,形成上述两种化合物的四种元素中电负性最大的是___(填元素符号)。
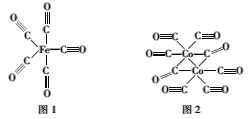
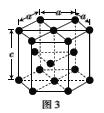
(3)金属钴的堆积方式为六方最密堆积,其配位数是___,钴晶体晶胞结构如图3所示,该晶胞中原子个数为___;该晶胞的边长为anm,高为cnm,该晶胞的密度为___(NA表示阿伏加德罗常数的值,列出代数式)g·cm-3。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)某温度下KW=10-12,则0.05mol/LH2SO4溶液的pH=____ ,0.01mol/LNaOH溶液的pH=______ 。
(2)下列叙述中与盐类的水解有关的是(______)
①明矾和FeCl3可作净水剂
②实验室配制AlCl3溶液时,应先把它溶在较浓的盐酸中,然后加水稀释
③为保存FeCl3溶液,要在溶液中加少量盐酸
④用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂
⑤实验室盛放Na2CO3溶液的试剂瓶应用橡皮塞,而不用玻璃塞
⑥NH4Cl与ZnCl2溶液可作焊接中的除锈剂
⑦长期使用硫酸铵,土壤酸性增强;草木灰与铵态氮肥不能混合施用
A.①④⑦ B.②⑤⑦ C.③⑥⑦ D.全部有关
(3)若1 mol N2完全转化为NH3的反应热为△H=-92 kJ/mol,拆开1 mol H—H键和1 mol N![]() N 键需要的能量分别是436 kJ和946 kJ,则拆开1 mol N—H键需要的能量是__________kJ。
N 键需要的能量分别是436 kJ和946 kJ,则拆开1 mol N—H键需要的能量是__________kJ。
(4)已知25℃ 时,醋酸的Ka=1.8×10-5 碳酸的Ka1=4.3×10-7 Ka2=5.6×10-11 。有①NaHCO3溶液②CH3COONa溶液③NaOH溶液④Na2CO3各25 mL,浓度均为0.1 mol·L-1四种溶液的pH由大到小的顺序为_________ (填序号)
(5)Na2CO3溶液加热后碱性增强,结合化学平衡移动原理解释原因:____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】运用化学链燃烧技术有利于提高燃料利用率。化学链燃烧技术的基本原理是借助载氧剂(如Fe2O3,FeO等)将燃料与空气直接接触的传统燃烧反应分解为几个气固反应,燃料与空气无须接触,由载氧剂将空气中的氧气传递给燃料。回答下列问题:
Ⅰ.以Fe2O3作载氧剂的化学链燃烧循环转化反应的部分热化学方程式如下,循环转化的原理如图所示:
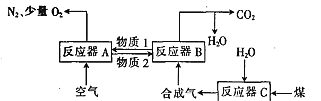
①C(s) +H2O(g) = CO(g)+ H2(g) ΔH = akJmol-1
②CO(g)+ H2(g) + O2(g) = CO2(g) +H2O(g) ΔH = bkJmol-1
(1)写出图中总反应的热化学方程式:_____________________________
(2)空气经反应器A后得到的尾气___________(填“能”或“不能”)直接用作工业合成氨的原料气,原因是_____________________。
Ⅱ.用FeO作载氧剂,部分反应的lgKp [K是用平衡分压(平衡分压=总压×物质的量分数)代替平衡浓度]与温度的关系如图所示。
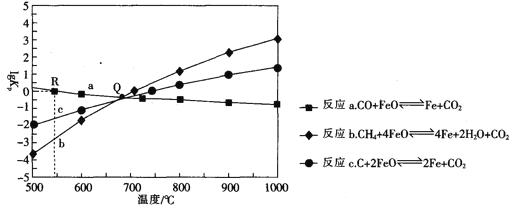
(3)图中涉及的反应中,属于吸热反应的是反应_________________(填字母)。
(4)R点对应温度下,向某恒容密闭容器中通入1molCO,并加入足量的FeO,只发生反应CO(g)+ FeO(s) ![]() CO2(g) +Fe(s),则CO的平衡转化率为______________.
CO2(g) +Fe(s),则CO的平衡转化率为______________.
Ⅲ.在T℃下,向某恒容密闭容器中加入1molCH4(g)和4mol FeO(s)进行反应:CH4(g) + 4FeO(s) ![]() 4Fe(s) +2H2O(g) +CO2(g)。反应起始时压强为P0,反应进行至10min时达到平衡状态,测得此时容器的气体压强是起始压强的2倍。
4Fe(s) +2H2O(g) +CO2(g)。反应起始时压强为P0,反应进行至10min时达到平衡状态,测得此时容器的气体压强是起始压强的2倍。
(5)T℃下,该反应的Kp = _____________________.
(6)若起始时向该容器中加入1molCH4(g),4molFeO(s),1mol H2O(g),0.5molCO2(g),此时反应向__________________(填“正反应”或“逆反应”)方向进行。
(7)其他条件不变,若将该容器改为恒压密闭容器,则此时CH4的平衡转化率___________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化碳的回收利用是环保和能源领域研究的热点课题,请根据要求回到下列问题:

(1)研究表明,利用太阳能可以将![]() 分解制收炭黑,其原理如图1所示,制取炭黑的化学反应方程式是______;
分解制收炭黑,其原理如图1所示,制取炭黑的化学反应方程式是______;
已知:①![]()
②![]()
则过程2 的热化学方程式为______。
(2)一定温度下,在密闭容器中进行反应![]() ,下列说法正确的是______
,下列说法正确的是______![]() 填字母序号
填字母序号![]()
A.当反应容器中压强不变时,反应达到平衡状态
B.升高温度,加快反应速率,![]() 的转化率增大
的转化率增大
C.增大![]() 的浓度,平衡向正反应方向移动,平衡常数增大
的浓度,平衡向正反应方向移动,平衡常数增大
D.平衡时CO、![]() 的体积分数一定相等
的体积分数一定相等
(3)在2L恒容密闭容器中充入![]() 和nmol
和nmol ![]() ,在一定条件下发生反应,
,在一定条件下发生反应,![]() ,
,![]() 的转化率与温度、投料比
的转化率与温度、投料比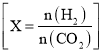 的关系如图2所示。
的关系如图2所示。
①该反应的平衡常数表达式为______,若![]() ,则B点的K______
,则B点的K______![]() 计算结果精确至
计算结果精确至![]() ;
;
②若在500K时,按![]() 投料,在恒压下进行,达到平衡状态,此时
投料,在恒压下进行,达到平衡状态,此时![]() 的转化率______
的转化率______![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() ;
;
(4)某研究团队设计出一种新型太阳能电池,能把大气中的二氧化碳转换成碳氢化合物燃料。如图3是通过
![]() 和
和![]() 作用制备
作用制备![]() 的原理示意图。b电极的电极反应为______。
的原理示意图。b电极的电极反应为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】今有室温下四种溶液,下列有关叙述不正确的是( )

A. ③和④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B. ②和③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C. 分别加水稀释10倍,四种溶液的pH:①>②>④>③
D. V1L ④与V2L ①溶液混合后,若混合后溶液pH=7,则V1<V2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com