
科目: 来源: 题型:
【题目】常温下,CH3COOH与NH3H2O的电离常数均为1.8×10-5。现向20mL浓度为0.1mol/LNH3H2O的溶液中滴加等物质的量浓度的CH3COOH溶液,所得混合液的导电率与加入CH3COOH溶液的体积(V)的关系如图所示。
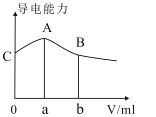
下列说法正确的是( )
A.a=20,A点溶液的pH=7
B.A、B两点中,B点溶液中水的电离程度最大
C.A点溶液中:c(CH3COO-)>c(NH4+)>c(H+)>c(OH-)
D.B、C两点中溶液的pH相等
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,下列溶液中,c(H+)由小到大的排列顺序是________
①0.1mol/L HCl溶液 ②0.1mol/L H2SO4溶液 ③0.1mol/L NaOH溶液 ④0.1mol/L CH3COOH溶液。
查看答案和解析>>
科目: 来源: 题型:
【题目】科研人员借助太阳能,将H2S转化为可再利用的S和H2的工作原理如图所示。下列叙述错误的是( )
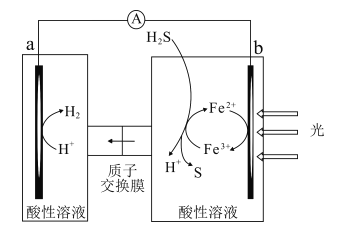
A.该电池能实现将光能转化为化学能
B.a电极的电极反应:2H++2e-=H2↑
C.光照后,b电极的电极反应:H2S-2e-=2H++S
D.a电极区溶液的pH不变
查看答案和解析>>
科目: 来源: 题型:
【题目】某学习小组探究SO2气体的性质,装置如图所示,下列说法不合理的是( )
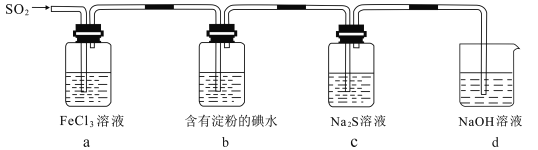
A.a装置中FeCl3溶液逐渐变为浅绿色,说明SO2有还原性
B.c装置Na2S溶液中出现浅黄色浑浊,说明SO2具有氧化性
C.b装置中蓝色退去,说明还原性:SO2> I-
D.b、c装置中发生反应转移的电子数一定相等
查看答案和解析>>
科目: 来源: 题型:
【题目】水的电离平衡曲线如图所示,若以A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度,则下列说法正确的是
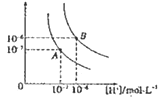
A. 纯水中25℃时的c(H+)比100℃时的c(H+)大
B. 25℃时某溶液中由水电离产生的c( H+)> =1×10-ll molL-1,则该溶液的pH可能是11或3
C. 将pH = 9的Ba(OH)2溶液与pH =4的稀盐酸混合,并保持100 ℃的恒温,混合溶液的PH=7,则此Ba(OH)2的溶液和盐酸的体积比为10:1
D. 100℃时,某 NaS04 溶液中 c(S042- ) =5 ×10 -4mol L-1,则溶液中 c(Na+): c(OH-)为104:1
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.0.1molNa2O2中阴离子的数目为0.2NA
B.1L0.1mol/L的HF溶液中F-数目为0.1NA
C.0.1molFe在点燃条件下与氧气反应时转移电子数目为0.3NA
D.0.4mol浓盐酸与足量的MnO2加热充分反应,产生Cl2的数目小于0.1NA
查看答案和解析>>
科目: 来源: 题型:
【题目】恒温条件下,在CH3COONa稀溶液中分别加入少量下列物质:
①固体NaOH;②固体KOH;③固体NaHSO4;④固体CH3COONa;⑤冰醋酸
其中一定可使c(CH3COO-)/c(Na+)比值增大的是 ( )
A. ①② B. ②⑤ C. ①⑤ D. ②④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】铝氢化钠(NaAlH4)是重要的还原剂。以铝土矿(主要成分Al2O3,含少量SiO2、Fe2O3等杂质)为原料制备NaAlH4的一种流程如图:
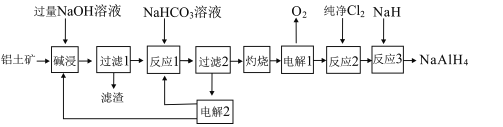
已知:碱浸中SiO2转化成难溶的Na2Al2SixO8
(1)Na2Al2SixO8用氧化物的形式表示为___(x用具体的数值表示)。
(2)过滤1得滤液的主要成分为NaOH和NaAlO2,写出反应1中NaHCO3与NaAlO2反应的离子方程式:___。
(3)电解2生成NaHCO3和NaOH用于循环使用,写出电解2阴极的电极反应式:___。
(4)反应3的化学方程式为___。
(5)铝氢化钠遇水发生剧烈反应产生大量气泡,其反应的化学方程式为___。
(6)滤渣主要成分有Na2Al2SixO8和Fe2O3,可以采用如图流程进行分离:

①滤渣溶于盐酸所得的固体物质可能为___(填化学式)。
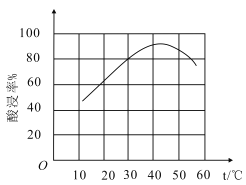
②滤渣溶于盐酸的“酸浸率”与温度关系如图所示,试解释温度过高,“酸浸率”降低的原因___。
③已知常温下,Ksp[Fe(OH)3]=8.0×10-38,Al3+开始沉淀的pH为4,(溶液中离子的浓度小于1×10-5mol/L为沉淀完全),从滤液中先分离出Fe3+,应调节pH范围为___(lg2≈0.3)。
查看答案和解析>>
科目: 来源: 题型:
【题目】碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。请回答下列问题:
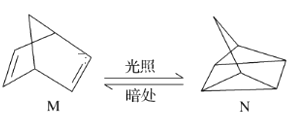
(1)有机物M经过太阳光光照可转化成N,转化过程如下,ΔH=+88.6 kJ·mol-1。则M、N相比,较稳定的是________。
(2)已知CH3OH(l)的燃烧热ΔH=-726.5 kJ·mol-1,CH3OH(l)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1则a________726.5(填“>”“<”或“=”)
O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1则a________726.5(填“>”“<”或“=”)
(3)将Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145.0 kJ热量,写出该反应的热化学方程式:________________________________________。
(4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料:4Al(s)+3TiO2(s)+3C(s)===2Al2O3(s)+3TiC(s) ΔH=-1 176.0 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为_______。
(5) 已知:①C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
②2CO(g)+O2(g)===2CO2(g) ΔH2=-566 kJ·mol-1
③TiO2(s)+2Cl2(g)===TiCl4(s)+O2(g) ΔH3=+141 kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s)===TiCl4(s)+2CO(g)的 ΔH=__________________。
(6)已知拆开1 mol H—H键,1 mol N—H键,1mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2(g)与H2(g)反应生成NH3(g)的热化学方程式为:________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】二正丁基锡羧酸酯是一种良好的大肠杆菌,枯草杆菌的杀菌剂。合成一种二正丁基锡羧酸酯的方法如图1:

将0.45g的2-苯甲酰基苯甲酸和0.500g的二正丁基氧化锡加入到50mL苯中,搅拌回流分水6小时。水浴蒸出溶剂,残留物经重结晶得到白色针状晶体。
各物质的溶解性表
物质 | 水 | 苯 | 乙醇 |
2-苯甲酰基苯甲酸 | 难溶 | 易溶 | 易溶 |
二正丁基氧化锡 | 难溶 | 易溶 | 易溶 |
正丁基锡羧酸酯 | 难溶 | 易溶 | 易溶 |
回答下列问题:
(1)仪器甲的作用是___,其进水口为___。
(2)实验不使用橡胶塞而使用磨口玻璃插接的原因是___。
(3)分水器(乙)中加蒸馏水至接近支管处,使冷凝管回流的液体中的水冷凝进入分水器,水面上升时可打开分水器活塞放出,有机物因密度小,位于水层上方,从分水器支管回流入烧瓶。本实验选用的分水器的作用是__(填标号)
A.能有效地把水带离反应体系,促进平衡向正反应方向移动
B.能通过观察水面高度不再变化的现象,判断反应结束的时间
C.分离有机溶剂和水
D.主要起到冷凝溶剂的作用
(4)回流后分离出苯的方法是__。
(5)分离出苯后的残留物,要经重结晶提纯,选用的提纯试剂是__(填标号)
A.水 B.乙醇 C.苯
(6)重结晶提纯后的质量为0.670g,计算二正丁基锡羧酸酯的产率约为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com