
科目: 来源: 题型:
【题目】一定温度下,探究铜与稀HNO3的反应过程如图:
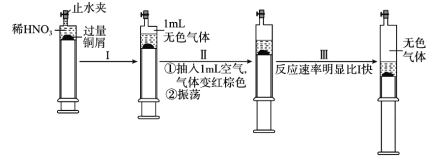
下列说法不正确的是( )
A.过程I中生成无色气体的离子方程式是3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O
B.步骤III反应速率比I快的原因是NO2溶于水,使c(HNO3)增大
C.由实验可知,NO2对该反应具有催化作用
D.当活塞不再移动时,打开止水夹,滴加稀硫酸,铜可以继续溶解
查看答案和解析>>
科目: 来源: 题型:
【题目】有一种化合物是很多表面涂层的重要成分,其结构如图所示,其中W、X、Y、Z为原子序数依次增大的短周期主族元素,只有X、Y在同一周期,Y无最高正价,Z的含氧酸均具有氧化性,下列有关说法正确的是( )
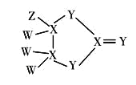
A.WZ沸点高于W2Y的沸点
B.含Z的两种酸反应可制得Z的单质
C.W2Y2中既含离子键又含共价键键
D.X的含氧酸一定为二元弱酸
查看答案和解析>>
科目: 来源: 题型:
【题目】[化学——选修5:有机化学基础]环丙贝特(H)是一种降血脂药物,可明显降低极低密度和低密度脂蛋白水平,并升高高密度脂蛋白,通过改善胆固醇的分布,可减少CH和LDL在血管壁的沉积,还有溶解纤维蛋白和阻止血小板凝聚作用。如图是合成环丙贝特的一种新方法:
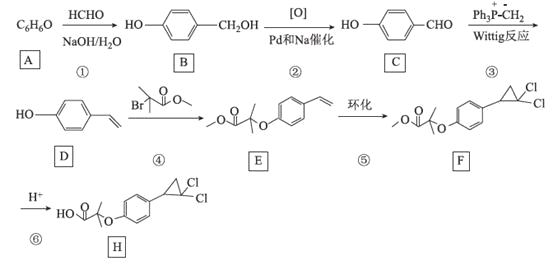
回答下列问题:
(1)C的化学名称为______________________
(2)F中含氧官能团的名称为______________
(3)H的分子式为________________________
(4)反应①的反应类型为___________,反应④的化学方程式为______________________
(5)M为![]() 的同分异构体,能与NaHCO3溶液反应产生气体,则M的结构共有种____(不考虑立体异构);其中1HNMR中有3组峰,且峰面积之比为6:2:1的结构简式为_______
的同分异构体,能与NaHCO3溶液反应产生气体,则M的结构共有种____(不考虑立体异构);其中1HNMR中有3组峰,且峰面积之比为6:2:1的结构简式为_______
(6)利用Wittig反应,设计以环己烷为原料(其他试剂任选),制备![]() 的合成路线:______________________。
的合成路线:______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】若用AG表示溶液的酸度,其表达式为:AG=lgc(H+)/c(OH-)。室温下,实验室里用0.1mol/L的盐酸溶液滴定10mL0.1mol/LMOH溶液,滴定曲线如下图所示。下列说法正确的是

A. 该流定过程可选择酚酞作为指示剂
B. 溶液中由水电离的c(H+):C点>D点
C. C点时加入盐酸溶液的体积等于10mL
D. 若B点加入的盐酸溶液体积为5mL,所得榕液中:c(M+)+c(H+)=c(MOH)+c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】四溴化钛(TiBr4)可用作橡胶工业中烯烃聚合反应的催化剂。已知TiBr4常温下为橙黄色固体,熔点为38.3℃,沸点为233.5℃,具有潮解性且易发生水解。实验室利用反应TiO2+C+2Br2![]() TiBr4+CO2制备TiBr4的装置如图所示。回答下列问题:
TiBr4+CO2制备TiBr4的装置如图所示。回答下列问题:
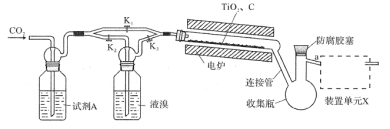
(1)检查装置气密性并加入药品后,加热前应进行的操作是__,其目的是__,此时活塞K1,K2,K3的状态为__;一段时间后,打开电炉并加热反应管,此时活塞K1,K2,K3的状态为____。
(2)试剂A为__,装置单元X的作用是__;反应过程中需用热源间歇性微热连接管,其目的是___。
(3)反应结束后应继续通入一段时间CO2,主要目的是___。
(4)将连接管切断并熔封,采用蒸馏法提纯。此时应将a端的仪器改装为__、承接管和接收瓶,在防腐胶塞上加装的仪器是___(填仪器名称)。
查看答案和解析>>
科目: 来源: 题型:
【题目】铂钴合金是以铂为基含钴二元合金,在高温下,铂与钴可无限互溶,其固体为面心立方晶格。铂钴合金磁性极强,磁稳定性较高,耐化学腐蚀性很好,主要用于航天航空仪表、电子钟表、磁控管等。氟及其化合物用途非常广泛。回答下列问题:
(1)聚四氟乙烯是一种准晶体,准晶体是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过____方法区分晶体准晶体和非晶体。
(2)基态F原子的价层电子排布图(轨道表达式)为______。
(3)[H2F]+[SbF6]-(氟锑酸)是一种超强酸,存在[H2F]+,该离子的空间构型为______,与[H2F]+具有相同空间构型和键合形式的分子和阴离子分别是______(各举一例)。
(4)NH4F(氟化铵)可用于玻璃的蚀刻防腐剂、消毒剂。NH4+中中心原子的杂化类型是______;氟化铵中存在______(填字母)。
A.离子键B.σ键C.π键D.氢键
(5)SF6被广泛用作高压电气设备的绝缘介质。SF6是一种共价化合物,可通过类似于Born-Haber循环能量构建能量图计算相关键能。则F-F键的键能为______kJmol-1,S-F键的键能为______kJmol-1。
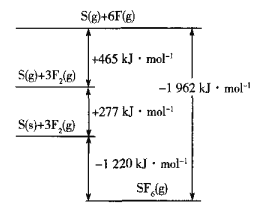
(6)CuCl的熔点为426℃,熔化时几乎不导电;CuF的熔点为908℃,密度为7.1gcm-3。
①CuF的熔点比CuCl的高,原因是______
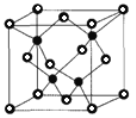
②已知NA为阿伏加德罗常数的值,CuF的晶胞结构如图(b)所示,则CuF的晶胞参数a=______nm(列出计算式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】Hagemann酯(H)是一种合成多环化合物的中间体,可由下列路线合成(部分反应条件略去):
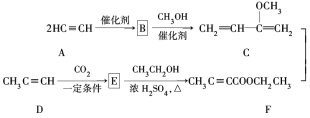
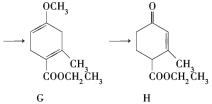
(1)A→B为加成反应,则B的结构简式是________;B→C的反应类型是_______。
(2)H中含有的官能团名称是__________;F的名称(系统命名)是_______。
(3)E→F的化学方程式是______________。
(4)TMOB是H的同分异构体,具有下列结构特征:①核磁共振氢谱除苯环吸收峰外仅有1个吸收峰;②存在甲氧基(CH3O-)。TMOB的结构简式是________。
(5)下列说法正确的是_______。
a.A能和HCl反应得到聚氯乙烯的单体
b.D和F用溴水可以鉴别
c.1 mol G完全燃烧生成7 mol H2O
d.H能发生加成、取代反应
查看答案和解析>>
科目: 来源: 题型:
【题目】在试管中先加入2 mL 95%的乙醇,并在摇动下缓缓加入2 mL浓硫酸,充分摇匀,冷却后再加入2 g无水醋酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上。在试管②中加入5 mL Na2CO3饱和溶液,按图示装置连接。用酒精灯对试管①加热,当观察到试管②中有明显现象时,停止实验。
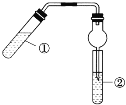
请回答下列问题:
(1)写出①中主要反应的化学方程式:______________。
(2)加入浓硫酸的目的是___________。
(3)试管②中观察到的现象是__________________。
(4)该实验中球形干燥管除起冷凝作用外,另一重要作用是_______,原因是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】四川盛产五倍子。以五倍子为原料可制得化合物A。A的结构简式如下图所示。请解答下列各题:

(1)A的分子式是__________________。
(2)有机化合物B在硫酸催化条件下加热发生酯化反应可得到A。请写出B的结构简式_________________。
(3)请写出A与过量NaOH溶液反应的化学方程式_________________。
(4)有机化合物C是合成治疗禽流感药物的原料之一。C可以看成是B与氢气按物质的量之比1∶2发生加成反应得到的产物。C分子中无羟基与碳碳双键直接相连的结构,它能与溴水反应使溴水褪色。请写出C与溴水反应的化学方程式: _________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理对于消除环境污染有重要意义。
(1)NO在空气中存在如下反应:2NO(g)+O2(g)![]() 2NO2(g) △H,上述反应分两步完成,其反应历程如下图所示:
2NO2(g) △H,上述反应分两步完成,其反应历程如下图所示:

回答下列问题:
①写出反应I的热化学方程式_________。
②反应I和反应Ⅱ中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g)![]() 2NO2(g)反应速率的是_______(填“反应I”或“反应Ⅱ”);对该反应体系升高温度,发现总反应速率反而变慢,其原因可能是__________(反应未使用催化剂)。
2NO2(g)反应速率的是_______(填“反应I”或“反应Ⅱ”);对该反应体系升高温度,发现总反应速率反而变慢,其原因可能是__________(反应未使用催化剂)。
(2)用活性炭还原法处理氮氧化物的有关反应为:C(s)+2NO(g)![]() N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及10min和20min各物质平衡浓度如表所示:
N2(g)+CO2(g)。向恒容密闭容器中加入一定量的活性炭和NO,T℃时,各物质起始浓度及10min和20min各物质平衡浓度如表所示:

①T℃时,该反应的平衡常数为_____________________(保留两位有效数字)。
②在10min时,若只改变某一条件使平衡发生移动,20min时重新达到平衡,则改变的条件是__________________________________。
③在20min时,保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,此时反应v正_______v逆(填“>”、“<”或“=”)。
(3)NO2存在如下平衡:2NO2(g)![]() N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
N2O4(g) △H<0,在一定条件下NO2与N2O4的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。

一定温度下,k1、k2与平衡常数kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是k1=____________;在上图标出点中,指出能表示反应达到平衡状态的点是___,理由是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com