
科目: 来源: 题型:
【题目】在一体积2L的密闭容器中加入反应物N2、H2,发生如下反应:N2(g)+3H2(g)![]() 2NH3(g)。反应过程中的部分数据如下表所示,下列说法正确的是
2NH3(g)。反应过程中的部分数据如下表所示,下列说法正确的是
物质的量/ mol 时间/min | n(N2) | n(H2) | n(NH3) |
0 | 1.0 | 1.2 | 0 |
2 | 0.9 | ||
4 | 0.75 | ||
6 | 0.3 |
A. 0~2 min内,NH3的反应速率为0.1 mol·Lˉ1·minˉ1
B. 2 min时, H2的物质的量0.3 mol
C. 4 min时,反应已达到平衡状态,此时正、逆反应的速率都为0
D. 4~6 min内,容器内气体分子的总物质的量不变
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸铁铵[aFe2(SO4)3·b(NH4)2SO4·cH2O]广泛用于城镇生活饮用水、工业循环水的净化处理等。某化工厂以硫酸亚铁(含少量硝酸钙)和硫酸铵为原料,设计了如下工艺流程制取硫酸铁铵。
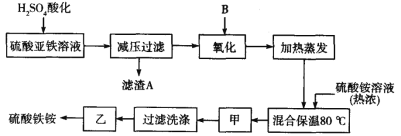
请回答下列问题:
(1)硫酸亚铁溶液加 H2SO4 酸化的主要目的是____________,滤渣 A的主要成分是______________。
(2)下列物质中最适合的氧化剂 B 是____________。
a.NaClO b.H2O2 c.KMnO4 d.K2Cr2O7
(3)操作甲、乙的名称分别是:甲_____________,乙_____________。
(4)上述流程中,有一处不严密,请指出并修改_____________。
(5)检验硫酸铁铵中NH4+的方法是_____________。
(6)称取 14.00 g 样品,将其溶于水配制成 100 mL 溶液,并分成两等份,向其中一份 中加入足量 NaOH 溶液,过滤洗涤得到 2.14 g 沉淀;向另一份溶液中加入 0.05 mol Ba(NO3)2 溶液,恰好完全反应。则该硫酸铁铵的化学式为_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据环保要求,在处理有氰电镀废水时,剧毒的CN-离子在催化剂TiO2颗粒作用下,先用NaClO将CN-离子氧化成CNO-(CN-和CNO-中N元素均为-3价),再在酸性条件下继续与NaClO反应生成N2、CO2和Cl2。环保工作人员在密闭系统中用如图装置进行实验,测定CN-被处理的百分率。

现将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200mL(其中CN-的浓度为0.2mol/L)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题:
(1)根据题意,写出相关主要反应的离子方程式:甲中的反应:____,乙中的反应:____。
(2)上述实验是通过测定CO2的量来确定对CN-的处理效果。丙装置中的试剂是____,丁装置的目的是_____;干燥管Ⅱ的作用是_____。
(3)假定上述每一个装置都充分吸收,则利用该装置测得的CN-被处理的百分率与实际值相比_____(填“偏高”或“偏低”),简述可能的原因:_____。
(4)若干燥管Ⅰ中碱石灰增重1.408g,则该实验中测得CN-被处理的百分率为____。
查看答案和解析>>
科目: 来源: 题型:
【题目】芳香化合物A是一种基本化工原料,可以从煤和石油中得到。OPA是一种重要的有机化工中间体。A、B、C、D、E、F和OPA的转化关系如图所示:

已知:2
回答下列问题:
(1)A的化学名称是____,B中官能团的名称是____,由A生成B的反应类型是____ 。
(2)写出C所有可能的结构简式____;
(3)D(邻苯二甲酸二乙酯)是一种增塑剂。请用A及不超过两个碳原子的有机物及合适的无机试剂为原料,经两步反应合成D。其合成路线为:_____;
(合成路线流程图示例如下:H2C=CH2![]() CH3CH3Br
CH3CH3Br![]() CH3CH2OH)
CH3CH2OH)
(4)由E可合成一种聚酯类高分子化合物F。
①1molE与足量饱和NaHCO3溶液反应可放出____LCO2(标况);
②由E合成F的反应类型为____,该反应的化学方程式为____。
查看答案和解析>>
科目: 来源: 题型:
【题目】ⅢA族的硼、铝、镓、铟、铊等元素在化合物中通常表现出+3价,含ⅢA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题。
(1)基态Ga原子价层电子排布式_____。
(2)砷化镓属于第三代半导体,晶胞结构与金刚石相似。下列说法正确的是_____。
A.砷化镓晶胞结构中Ga原子的轨道杂化方式为sp3
B.第一电离能:As<Ga
C.电负性:As<Ga
D.砷和镓都属于p区元素
(3)BCl3的立体构型是____,由第二周期元素组成的与BCl3互为等电子体的阴离子为____。
(4)已知:Al的燃烧热为△H1=akJ·mol-1;Fe2O3(s)+2Al(s)=Al2O3(s)+2Fe(s);ΔH2=bkJ/mol,则:3O2(g)+4Fe(s)=2Fe2O3(s);ΔH3=____kJ/mol。
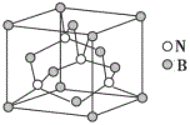
(5)人造立方氮化硼晶胞如图所示,判断该晶体结构中存在配位键的依据是____。设该晶体的摩尔质量为Mg/mol,晶体的密度为ag/cm3,阿伏加德罗常数的值为NA,则晶体中两个距离最近的B原子之间的距离为____cm。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO等)制取草酸钴的工艺流程如图:
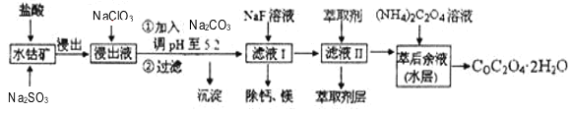
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
(1)浸出过程中加入Na2SO3的目的是_____。
(2)NaClO3在反应中氯元素被还原为最低价,该反应的离子方程式为_____。
(3)加Na2CO3能使浸出液中某些金属离子转化成氢氧化物沉淀。试用离子方程式和必要的文字简述其原理:_____。
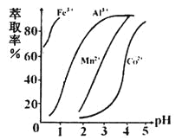
(4)萃取剂对金属离子的萃取率与pH的关系如图所示,在滤液II中适宜萃取的pH为_____左右。
a.2.0~2.5 b.3.0~3.5 c.4.0~4.5
(5)滤液I“除钙、镁”是将其转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10,当加入过量NaF后,所得滤液![]() =____。
=____。
(6)工业上用氨水吸收废气中的SO2。已知NH3·H2O的电离平衡常数K=1.8×10-5,H2SO3的电离平衡常数K1=1.2×10-2,K2=1.3×10-8。在通废气的过程中,当恰好形成正盐时,溶液中离子浓度的大小关系为____。
查看答案和解析>>
科目: 来源: 题型:
【题目】在t℃下,某反应达到平衡,平衡常数K=![]() 。恒容时,温度升高时NO浓度减小。下列 说法正确的是
。恒容时,温度升高时NO浓度减小。下列 说法正确的是
A.该反应的焓变为正值
B.若恒温下增大压强(缩小体积),则反应体系的颜色加深
C.在t℃时,加入催化剂,该反应的化学平衡常数增大
D.该反应化学方程式为NO+SO3![]() NO2+SO2
NO2+SO2
查看答案和解析>>
科目: 来源: 题型:
【题目】下列热化学方程式书写正确的是:
A.2SO2+O2![]() 2SO3 ΔH=-196.6 kJ·mol-1
2SO3 ΔH=-196.6 kJ·mol-1
B.H2(g)+ ![]() O2(g)=H2O(l) ΔH=-285.5 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.5 kJ·mol-1
C.2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ
D.C(s)+O2(g)=CO2(g) ΔH=+393.5 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,10mL 0.40 mol·L-1H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 3 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是( )(溶液体积变化忽略不计)
A. 反应至6min时,H2O2分解了50%
B. 反应至6min时,c(H2O2)=0.20 mol·L-1
C. 0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol/(L·min)
D. 4~6min的平均反应速率:v(H2O2)>3.3×10-2mol/(L·min)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列事实能用勒夏特列原理解释的是
A. 工业制硫酸在二氧化硫催化氧化时采用高温来提高单位时间SO3的产量
B. 合成氨工业中使用铁触媒做催化剂来加快反应速率
C. 用饱和食盐水来除去氯气中氯化氢杂质
D. 对于2HI(g)![]() H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com