
科目: 来源: 题型:
【题目】第四期某些过渡元素在工业生产中有着极其重要的作用。
(1)铬是最硬的金属单质,被称为“不锈钢的添加剂”。
写出Cr在周期表中的位置___________;其原子核外电子排布的最高能层符号___________.
(2)在1 mol CrO5(其中Cr为+6价)中,含有过氧键的数目为___________。
(3)钒(23V)是我国的丰产元素,被称之为“工业的味精”,广泛用于催化及钢铁工业。回答下列问题:
写出钒原子价电子排布图___________;V2O5常用作SO2转化为SO3的催化剂。SO3的三聚体环状结构如图所示,该结构中S原子的杂化轨道类型为___________;

(4)Ni是一种优良的有机反应催化剂,Ni能与CO形成正四面体形的配合物Ni(CO)4,其中配原子是___________。
(5)钛称之为21世纪金属,具有一定的生物功能。钙钛矿(CaTiO3)晶体是工业获取钛的重要原料。 CaTiO3晶胞如下图,边长为a=0.266m,晶胞中Ti、Ca、O分别处于顶角、体心、面心位置。Ti与O间的最短距离为___________nm,与Ti紧邻的O个数为___________。

(6)在CaTiO3晶胞结构的另一种表示中,Ca处于各顶角位置,则T处于___________位置,O处于___________位置。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知稀溶液中①H+(aq)+OH-(aq)![]() H2O(l) △H1=-57.3kJ·mol-1;
H2O(l) △H1=-57.3kJ·mol-1;
②![]() Ba(OH)2(aq)+
Ba(OH)2(aq)+ ![]() H2SO4(aq)=
H2SO4(aq)=![]() BaSO4(s)+H2O(l) △H2下列结论正确的是
BaSO4(s)+H2O(l) △H2下列结论正确的是
A.中和反应的△H=-57.3kJmol-1B.△H2<△H1
C.△H2>△H1D.中和热的数值与实际发生反应的酸碱量有关
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是
A.将0. 5mol N2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为N2(g)+3 H2(g) ![]() 2 NH3(g) ΔH=-38.6kJmol-1
2 NH3(g) ΔH=-38.6kJmol-1
B.C(石墨)=C(金刚石)ΔH=+1.9kJmol-1,说明金刚石比石墨稳定
C.甲烷的燃烧热△H=-890. 3 kJmol-1,甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890. 3 kJmol-1
D.已知H+(aq)+OH-(aq)=H2O(l)△H=-57.4 kJmol-1,20g氢氧化钠固体溶于稀盐酸中恰好完全反应时放出的热量大于28.7kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】燃煤废气中的氮氧化物(NOx)、CO2、SO2等气体,常用下列方法处理,以实现节能减排、废物利用等。已知:25℃ 时,Kb(NH3·H2O)=1.8×10-5; H2SO3:Ka1=1.5×10-2,Ka2=1.0×10-7。
(1)处理烟气中的SO2常用液吸法。室温条件下,将烟气通入浓氨水中得到(NH4)2SO3溶液,0.1mol/L(NH4)2SO3溶液的pH____(填“>”“<”或“=”)7。
(2)用活性炭可以还原处理氮氧化物,有关反应为C(s)+2NO(g) N2(g)+CO2(g)。在恒容条件下,能判断该反应一定达到平衡状态的依据是 ________(填选项编号)。
A.单位时间内生成2nmolNO(g)的同时消耗nmolCO2(g)
B.混合气体的密度不再发生改变
C.反应体系的压强不再发生改变
D.混合气体的平均相对分子质量不再改变
(3)有科学家经过研究发现,用CO2和H2在210~290℃,催化剂条件下可转化生成甲醇蒸气和水蒸气。
①230℃,向容器中投入0.5molCO2和1.5molH2,当转化率达80% 时放出热量19.6kJ能量,写出该反应的热化学方程式__________________。
②一定条件下,往 2L恒容密闭容器中充入1.0molCO2和3.0molH2,在不同催化剂作用下,相同时间内 CO2的转化率随温度的变化如图1所示:
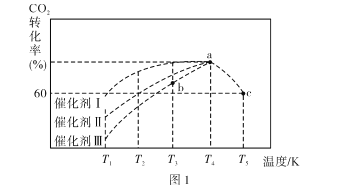
催化剂效果最佳的是催化剂________(填“Ⅰ”“Ⅱ”“Ⅲ”)。b点v( 正 )________v( 逆 )( 填“>”“<”或“=”) 。此反应在 a 点时已达平衡状态,a 点的转化率比 c 点高的原因_____。已知容器内的起始压强为100kPa,则图中c点对应温度下反应的平衡常数Kp=____________KPa-2 。(保留两位有效数字,Kp为以分压表示的平衡常数,分压=总压×物质的量分数)
(4)一定条件下,CO2和H2也可以发生反应CO2(g)+H2(g) CO(g)+H2O(g) ΔH<0,一定温度下,在3L容积可变的密闭容器中发生如上反应,已知c(CO)与反应时间t变化曲线Ⅰ如图2所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ或曲线Ⅲ。当曲线Ⅰ变为曲线Ⅲ时,改变的条件是____________________。
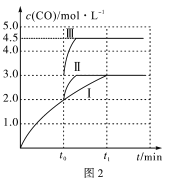
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向20mL0.1mol/L NaHA(酸式盐)溶液中分别滴加0.1mol/L 盐酸或0.1mol/L NaOH溶液,溶液的pH与滴加溶液体积关系如图所示。下列推断正确的是( )
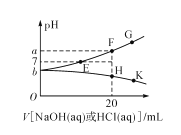
A.NaHA在水中电离程度大于水解程度
B.在对应的各点溶液中,H点水电离程度最大
C.E点对应的溶液中有c(Na+)=c(HA-)+c(A2-)
D.F点对应的溶液中存在c(H+)+c(Na+)=(OH-)+c(HA-)+c(A2-)
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物M的结构简式为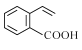 ,下列说法正确的是 ( )
,下列说法正确的是 ( )
A.有机物M既能使酸性KMnO4溶液褪色又能使溴水褪色,且反应类型相同
B.与有机物M具有相同的官能团,且不包括M的同分异构体有3种
C.1mol有机物M与足量氢气反应,消耗氢气4mol
D.有机物M能发生取代、加成、氧化、水解等反应
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年诺贝尔化学奖颁给了日本吉野彰等三人,以表彰他们对锂离子电池研发的卓越贡献。
(1)自然界中主要的锂矿物为锂辉石、锂云母、透锂长石和磷锂铝石等。为鉴定某矿石中是否含有锂元素,可以采用焰色反应来进行鉴定,当观察到火焰呈________,可以认为存在锂元素。
A.紫红色 B.紫色 C.黄色
(2)工业中利用锂辉石(主要成分为LiAlSi2O6,还含有FeO、CaO、MgO等)制备钴酸锂(LiCoO2)的流程如下:
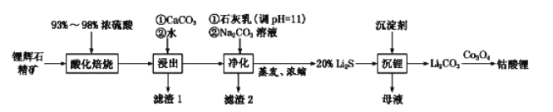
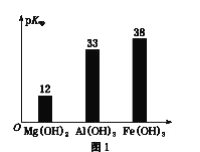
已知:部分金属氢氧化物的pKsp(pKsp=-lgKsp)的柱状图如图1。
回答下列问题:
①锂辉石的主要成分为LiAlSi2O6,其氧化物的形式为________。
②为提高“酸化焙烧”效率,常采取的措施是________。
③向“浸出液”中加入CaCO3,其目的是除去“酸化焙烧”中过量的硫酸,控制pH使Fe3+、A13+完全沉淀,则pH至少为_______。(已知:完全沉淀后离子浓度低于1×l0-5)mol/L)
④“沉锂”过程所获得的“母液”中仍含有大量的Li+,可将其加入到“___________”步骤中。
⑤Li2CO3与Co3O4在敞口容器中高温下焙烧生成钴酸锂的化学方程式为__________
(3)利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LiCoO2+C6 ![]() LixC6+Li1-xCoO2 ,其工作原理如图2。
LixC6+Li1-xCoO2 ,其工作原理如图2。
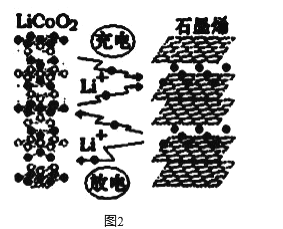
下列关于该电池的说法正确的是___________(填字母)。
A.电池反应式中过程1为放电过程
B.该电池若用隔膜可选用质子交换膜
C.石墨烯电池的优点是提高电池的储锂容量进而提高能量密度
D.充电时,LiCoO2 极发生的电极反应为LiCoO2-xe-=xLi++Li1-xCoO2
E.对废旧的该电池进行“放电处理”让Li+嵌入石墨烯中而有利于回收
查看答案和解析>>
科目: 来源: 题型:
【题目】对乙酰氨基苯酚X是常用的非甾类消炎解热镇痛药。可用如下路线来合成:
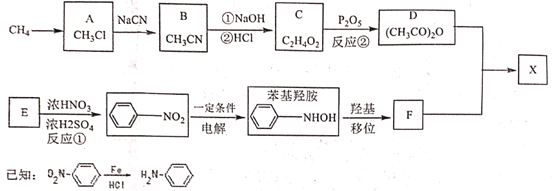
请回答下列问题:
(1)下列说法正确的是:_____________
A 反应①②皆为取代反应 B 有机物D能与水反应生成C
C F既能与强酸反应又能与强碱反应 D X分子中含有酚羟基和肽键两种官能团
(2)X与足量氢氧化钠反应的化学方程式:_____________。
(3)分析F分子结构特点和X合成原理后,认为制得X中有某种副产物,请写出该副产物的结构简式:___
(4)写出同时满足下列条件的X的所有同分异构体的结构简式:__________
①分子中含有-NH2;
②与氯化铁溶液发生显色反应;
③苯环上的取代基不超过3个且苯环上只有两种不同环境的H
(5)请设计以甲苯为原料合成![]() 的路线(用流程图表示,无机物任选)__________
的路线(用流程图表示,无机物任选)__________
查看答案和解析>>
科目: 来源: 题型:
【题目】CuCl广泛应用于化工和印染等行业。某研究性学习小组拟热分解CuCl2·2H2O制备CuCl,并进行相关探究。
该小组用下图所示装置进行实验(夹持仪器略)
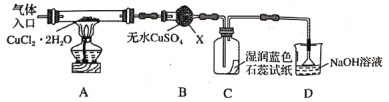
已知实验操作的步骤为:a.检查装置的气密性后加入药品→b.在“气体入口”处通入干燥HCl→c.点燃酒精灯,加热→d.反应一段时间,熄灭酒精灯,冷却→e.停止通入HCl,然后通入N2
(资料查阅)![]()
请回答下列问题:
(1)仪器X的名称是___________。
(2)在实验过程中,观察到B中物质由白色变为蓝色,C中试纸的颜色变化是___________。
(3)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质。根据资料信息
①若杂质是CuCl2,则产生的原因是_______________。
②若杂质是CuO,则产生的原因是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】三苯甲醇是有机合成中间体。实验室用格式试剂(![]() )与二苯酮反应制备三苯甲醇。
)与二苯酮反应制备三苯甲醇。
已知:①格式试剂非常活泼,易与水反应
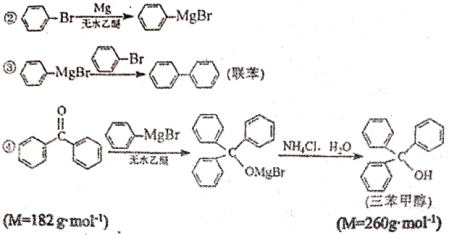
实验过程如下:
①合成格氏试剂:实验装置如图1所示,向三颈烧瓶加入0.75g镁屑和1小粒碘,装好装置,在恒压漏斗中加入3.20 mL溴苯(0.03 mol)和15.00 mL乙醚混匀,开始缓慢滴入三颈烧瓶,滴完后待用。
②制备三苯甲醇:实验装置如图1所示,将5.5g二苯酮与15 mL乙醇在恒压漏斗中混匀,滴入三颈烧瓶。40℃左右水浴回流0.5h,加入20mL饱和氯化铵溶液,使晶体析出,经过系列操作得到粗产品。
③提纯:用图2所示装置进行提纯,最后冷却抽滤.
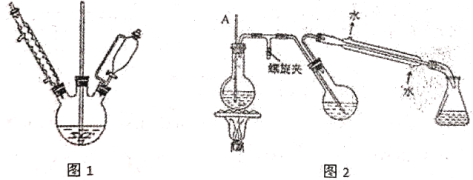
(1)实验中乙醚溶剂必须预先用_______试剂除去溶解在其中痕量的水,再经过_______得到;
A 浓硫酸 B 金属钠 C 过滤 D 蒸馏
(2)图1实验中,实验装置存在缺陷,应在球形冷凝管上连接_________装置;
(3)合成格氏试剂过程中,如果混合液滴加过快将导致格氏试剂产率下降,其原因是_______;
(4)在制备三苯甲醇的过程中,不能先将20mL饱和氯化铵溶液一起加入后再水浴回流的原因是__________;
(5)步骤②中系列操作为_________、过滤、洗涤、_________;
A 蒸发结晶 B 冷却结晶 C 高温烘干 D 滤纸吸干
(6)下列关于减压过滤的操作或说法正确的是________
A 滤纸大小适当,盖满所有孔,用溶剂润湿滤纸,微开水龙头,抽气使滤纸紧贴漏斗瓷板上
B 不宜过滤胶状沉淀,因为胶状沉淀颗粒太小易在滤纸上形成一层密实的沉淀
C 减压过滤完毕,先关闭水龙头,后拆下连接抽气泵和吸滤瓶的橡皮管,防止倒吸
D 实验过程要注意吸滤瓶内液面高度,当快到达支管口位置时,应先拔掉吸滤瓶上的橡皮管,再从支管口倒出滤液
E 当过滤的溶液具有强酸性、强氧化性时,可用玻璃纤维代替滤纸或用玻璃砂漏斗代替布氏漏斗
(7)通过提纯得到产品4.00g,则本实验产率为_________(计算结果保留3位有效数字)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com