
科目: 来源: 题型:
【题目】新型锂空气电池具有使用寿命长、可在自然空气环境下工作的优点。其原理如图所示(电解质为离子液体和二甲基亚砜),电池总反应为:![]() 下列说法不正确的是( )
下列说法不正确的是( )
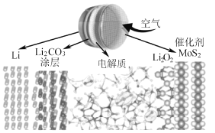
A.充电时电子由Li电极经外电路流入Li2O2
B.放电时正极反应式为2Li++O2 +2e-=Li2O2
C.充电时Li电极与电源的负极相连
D.碳酸锂涂层既可阻止锂电极的氧化又能让锂离子进入电解质
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃、101 kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是( )
A. 2H2(g)+O2(g) == 2H2O(1) △H= ―285.8kJ/mol![]()
B. 2H2(g)+ O2(g) == 2H2O(1) △H= +571.6 kJ/mol
C. 2H2(g)+O2(g) == 2H2O(g) △H= ―571.6 kJ/mol
D. H2(g)+1/2O2(g) == H2O(1) △H= ―285.8kJ/mol
查看答案和解析>>
科目: 来源: 题型:
【题目】滴定实验是化学学科中重要的定量实验。请回答下列问题:
Ⅰ.酸碱中和滴定——已知某NaOH试样中含有NaCl杂质,为测定试样中NaOH的质量分数,进行如下实验:
①称量1.00 g样品溶于水,配成250 mL溶液;
②准确量取25.00 mL所配溶液于锥形瓶中;
③滴加几滴酚酞溶液;
④用0.10 mol/L的盐酸标准液滴定三次,每次消耗盐酸的体积记录如下:
滴定序号 | 待测液体积mL | 所消耗盐酸标准液的体积/mL | |
滴定前读数 | 滴定后读数 | ||
1 | 25.00 | 0.50 | 20.60 |
2 | 25.00 | 6.00 | 26.00 |
3 | 25.00 | 1.10 | 21.00 |
(1)用__________滴定管(填“酸式”或“碱式”)盛装0.10 mol/L的盐酸标准液
(2)试样中NaOH的质量分数为__________
(3)若出现下列情况,测定结果偏高的是________
A.滴定前用蒸馏水冲洗锥形瓶
B.在振荡锥形瓶时不慎将瓶内溶液溅出
C.若在滴定过程中不慎将数滴酸液滴在锥形瓶外
D.酸式滴定管滴至终点时,俯视读数
E.酸式滴定管用蒸馏水洗后,未用标准液润洗
Ⅱ.氧化还原滴定
(4)取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1 mol·L-1的高锰酸钾溶液滴定,发生的反应为2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O滴定时,KMnO4溶液应装在酸式滴定管中,滴定终点时现象是__________
(5)用0.01 mol/L的I2标准溶液滴定未知浓度的Na2S2O3溶液,选用的指示剂是__________
查看答案和解析>>
科目: 来源: 题型:
【题目】依据题目要求回答下列问题。
(1)常温下,浓度均为0.1 mol/L的下列六种溶液的pH如表所示。
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
①上述盐溶液中的阴离子结合H+能力最强的是________。
②根据表中数据,浓度均为0.01 mol/L的下列五种物质的溶液中,酸性最强的是________(填字母编号,下同);将各溶液分别稀释100倍,pH变化最小的是________。
a. HCN b.HClO c. C6H5OH d. CH3COOH e. H2CO3
③下列关于NaHCO3饱和溶液的表述,正确的是________
A. c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
B. c(Na+)+c(H+)=c(HCO3-)+c(OH-)
C.HCO3-的电离程度大于HCO3-的水解程度
④根据上表数据,请你判断下列反应不能成立的是________。
a. CH3COOH+Na2CO3=NaHCO3+CH3COONa
b. CH3COOH+NaCN=CH3COONa+HCN
c. CO2+H2O+NaClO=NaHCO3+HClO
d. CO2+H2O+2C6H5ONa=Na2CO3+2C6H5OH
⑤要增大氯水中![]() 的浓度,可向氯水中加入少量的碳酸氢钠溶液,写出Cl2与HCO3-反应的离子方程式为________。
的浓度,可向氯水中加入少量的碳酸氢钠溶液,写出Cl2与HCO3-反应的离子方程式为________。
(2)依据表中数据计算CH3COOH的电离常数Ka=________(已知100.4=2.5,用科学计数法表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上以钒钛磁铁矿为原料,在炼铁的同时还可以制备钒的最高价氧化物V2O5,其主要流程如下:
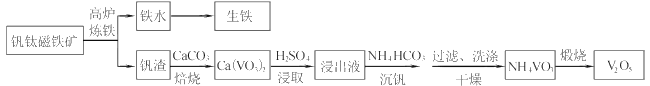
已知:①VO3-+2H+![]() VO2++H2O
VO2++H2O
②NH4VO3微溶于冷水,易溶于热水,不溶于乙醇
(1)高炉炼铁应用的冶炼方法是____(填标号)
A.热分解法 B.热还原法 C.电解法
(2)钒渣中的V2O3在焙烧时转化为Ca(VO3)2,写出该反应的化学方程式__。
(3)Ca(VO3)2难溶于水但能溶于稀硫酸,试用平衡移动原理分析其原因_,浸出液中含钒物质的化学式为___。
(4)沉钒过程有气体生成,其反应的离子方程式为__。
(5)过滤后用乙醇代替水来洗涤沉淀的原因是__。
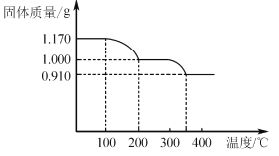
(6)煅烧NH4VO3时,固体质量随温度变化的曲线如图所示。加热到200℃时,得到的固体物质化学式为__,300~350℃放出的气态物质化学式为__。
查看答案和解析>>
科目: 来源: 题型:
【题目】在室温下,下列五种溶液:①0.1 mol/L NH4Cl;②0.1 mol/L CH3COONH4;③0.1 mol/L NH4HSO4;④0.1 mol/L NH3·H2O和0.1 mol/L NH4Cl混合液;⑤0.1 mol/L NH3·H2O,请根据要求填写下列空白:
(1)溶液①呈__________性(填“酸”、“碱”或“中”),其原因是__________。(用离子方程式表示)
(2)比较溶液①、②、③、⑤中c(NH4+)的由大到小的顺序__________。
(3)在溶液④中,__________离子的浓度为0.1 mol/L;NH3·H2O和__________离子的物质的量浓度之和为0.2 mol/L。
(4)室温下,测得溶液②的pH=7,则说明CH3COO-的水解程度__________(填“>”、“<”或“=”)NH4+的水解程度,CH3COO-与NH4+浓度的大小关系是:c(CH3COO-)_______c(NH4+)(填“>”、“<”或“=”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列字母分别代表一种元素.

(1)常温下,其单质呈液态的元素是____(填字母代号),它与e形成的化合物电子式为:_____(用元素符号表示)
b元素形成的单质所属品体类型可能是____(填序号)
①分子晶体 ②原子晶体 ③金属晶体 ④离子晶体 ⑤过渡型晶体
(2)元素c、d、g的氢化物的沸点由高到低的顺序为______(用化学式表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下面的反应路线及所给信息填空.
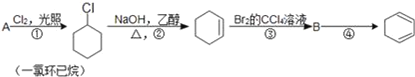
(1)A的结构简式是___,名称是_____.比A少2个碳原子的同系物中,写出其同分异构体是链烃的结构简式____.
(2)①的反应类型是____,③的反应类型是___.
(3)反应④的化学方程式是___.
查看答案和解析>>
科目: 来源: 题型:
【题目】为测定一置于空气中的某硫酸酸化的FeSO4溶液中Fe2+被氧化的百分率,某同学准确量取pH=1(忽略Fe2+、Fe3+的水解)的FeSO4溶液200mL,加入过量BaCl2溶液,充分反应后过滤、洗涤、干燥,得到沉淀28.0g;再另取同样的FeSO4溶液200mL,向其中加入过量NaOH溶液,搅拌使其充分反应,待沉淀全部变为红褐色后,过滤、洗涤并灼烧所得固体,最终得固体8.0g.
(1)写出反应中涉及的化学方程式(至少3个)__、__、__
(2)通过计算,填写下表:
c(H+) | c(SO42﹣) | c(Fe2+、Fe3+) |
__ | __ | __ |
注:c(Fe2+、Fe3+)表示Fe2+和Fe3+的总的物质的量的浓度
(3)计算原溶液中Fe2+被氧化的百分率__.
查看答案和解析>>
科目: 来源: 题型:
【题目】某校化学实验兴趣小组为了探究在实验室制备 Cl2 的过程中有水蒸气和 HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置 ( 支撑用的铁架台省略 ),按要求回答问题.
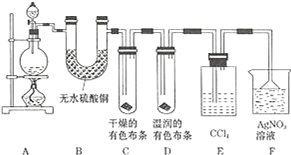
(1)下列方法中,可制得氯气的正确组合是___.(已知酸性条件下,K2Cr2O7、KClO3的氧化性均强于Cl2;酒精灯可以不用)
①MnO2 和浓盐酸混合共热; ②次氯酸钠和浓盐酸混合;③K2Cr2O7 和浓盐酸混合; ④KClO3 和浓盐酸混合共热;⑤KMnO4和浓盐酸混合;
A 只有① B 只有①⑤ C 只有①③④⑤ D 全部可以
(2)若用含有 0.2mol HCl 的浓盐酸与足量的 MnO2 反应制 Cl2,制得的 Cl2 体积 ( 标准状况下 )总是小于1.12L的原因是___.
(3)装置 B 的作用____,现象是____.
(4)装置 C 和 D 出现的不同现象说明的问题是___、装置 E 的作用是____.
(5)写出装置 F 中发生反应的离子方程式____.
(6)乙同学认为甲同学的实验有缺陷,不能确保最终通入 AgNO3 溶液中的气体只有一种.为了确保实验结论的可靠性,证明最终通入 AgNO3 溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置.你认为该装置应加在__与__之间 ( 填装置字母序号 ),装置中应放入___.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com