
科目: 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.加铝粉能放出氢气的溶液:Na+、NO3-、Cl-、Ba2+
B.滴加甲基橙显红色的溶液:K+、NH4+、Cl-、SO42-
C.![]() =1013的溶液:Fe2+、Cl-、MnO4-、SO42-
=1013的溶液:Fe2+、Cl-、MnO4-、SO42-
D.使红色石蕊试纸变蓝色的溶液:Na+、ClO-、Cl-、S2-
查看答案和解析>>
科目: 来源: 题型:
【题目】醛类是香料中重要的一族,铃兰醛具有令人愉快的香味。以下是合称铃兰醛的一种路线:
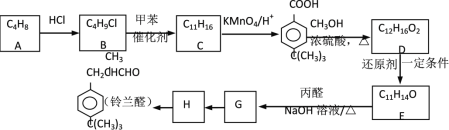
已知:① R1―CHO + R2―CH2―CHO ![]() R1―CH=C―CHO
R1―CH=C―CHO
② R―Cl +![]()
![]()
![]() + HCl
+ HCl
完成下列填空:
(1)写出A的名称_____________。
(2)写出结构简式:C_______;E_________。
(3)化合物M是G的芳香族同分异构体,M符合以下条件:
①能发生银镜反应;②在苯环的1,3,5位有三个侧链,其中两个烃基是C2H3和C4H9,则符合条件M的同分异构体共_______种。
(4)写出H生成铃兰醛的化学方程式:_______。
(5)E向G转化的过程中,常有分子式为C17H22O的副产物K产生。K的结构简式______。
查看答案和解析>>
科目: 来源: 题型:
【题目】用钒钛磁铁矿为原料冶炼铁,产生一种固体废料,主要成分如下表。
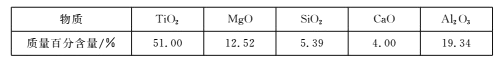
通过下列工艺流程可以实现元素Ti、Al、Si的回收利用,并得到纳米二氧化钛和分子筛。
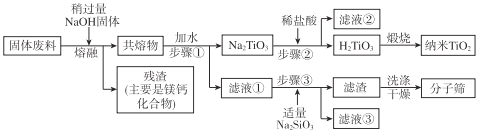
请回答下列问题:
(1)步骤①②③中所用的玻璃仪器___。
(2)下列固体废料的成分中,不属于碱性氧化物的是___(填字母序号)。
a.TiO2 b.SiO2 c.MgO d.CaO
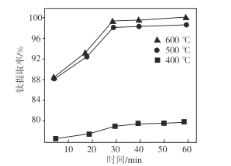
(3)熔融温度和钛的提取率关系如图,适宜温度为500℃,理由是___。
(4)滤液①中溶质的主要成分是___。
(5)步骤②中发生反应的离子方程式是___。
(6)将步骤③中制取分子筛的化学方程式补充完整:
![]() ___+6Na2SiO3+8H2O=Na8Al6Si6O24(OH)2·2H2O+
___+6Na2SiO3+8H2O=Na8Al6Si6O24(OH)2·2H2O+![]() ___
___
根据成分表中数据,计算100kg固体废料,理论上应再加入Na2SiO3物质的量的计算式是n(Na2SiO3)=___mol(摩尔质量/g/mol:SiO2-60,Al2O3-102)。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用如下图所示的装置,模拟工业用含硫废水生产Na2S2O3·5H2O的过程。

锥形瓶C中发生反应:① Na2S+ H2O+SO2→ Na2SO3+ H2S② 2H2S+ SO2→ 3S↓+ 2 ③S+ Na2SO3![]() Na2S
Na2S
(1)若配制11.5mol/L的硫酸50 mL,需98.3%(密度1.84 g/cm3)的浓硫酸______mL,配制所需要的玻璃仪器有烧杯、玻璃棒、________。
(2)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若_______,则整个装置气密性良好。装置D的作用是______。装置E中为______溶液。
(3)装置B可用于观察SO2的生成速率,其中的液体最好选择__________。
a 饱和食盐水 b 饱和Na2SO3溶液
c 饱和NaHSO3溶液 d 饱和NaHCO3溶液
锥形瓶C的溶液中含有Na2S和过量的Na2SO3。已知反应③的速率是三个反应中最慢的,则锥形瓶C中反应达到终点的现象是_________。
(4)反应结束后,锥形瓶C的溶液中除含Na2S2O3,还可能含Na2SO3、Na2SO4等杂质。用所给试剂设计实验,检测锥形瓶C的溶液中是否存在Na2SO4(供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液)简要说明实验操作,现象和结论:_____________。
(5)实验前锥形瓶C溶液中含有0.08molNa2S和0.04molNa2SO3,反应结束后经一系列操作,得到纯净的Na2S2O3·5H2O晶体19.11g,则Na2S2O3·5H2O产率是_______。(Na2S2O3·5H2O式量248)
查看答案和解析>>
科目: 来源: 题型:
【题目】做完海带提碘实验后,实验室得到了含碘废液(含水、CCl4、可能含I2、I—、IO3—的一种或几种),为测定废液中碘的存在形式,并回收废液中的碘和CCl4,设计了如下实验方案。完成下列填空:
Ⅰ.判断废液中碘的存在形式(已知:5SO32—+ 2IO3—+2H+→I2+5SO42—+H2O)
实验中可供选择的试剂是:稀盐酸、淀粉溶液、氯化铁溶液、亚硫酸钠溶液
(1)观察废液,废液分为上下两次,有机层在____层(填“上”或“下”),呈____色。
(2)从废液中取少量水层溶液(pH≈8),滴加淀粉溶液,变为蓝色,该废水中含I2;另从废液中取适量水层溶液用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出有I2存在;取________ ,该废水中含有I—;取______,该废水中不含IO3—。
Ⅱ.回收该废液中的碘和CCl4
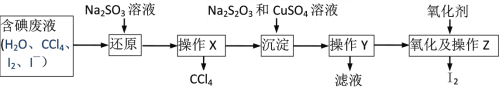
(3)向含碘废液中加入稍过量的Na2SO3溶液,将I2还原为I—,该操作的目的是_______;操作X名称是________。
(4)Na2S2O3、CuSO4溶液和I—反应生成CuI沉淀和Na2S4O6溶液,已知该含碘废液中碘元素的含量为10.33g/L,若回收500mL该含碘废液中的碘,则至少需要2mol/L的硫酸铜溶液_______mL。
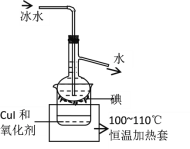
(5)将CuI转移入烧杯中,加入氧化剂在如图所示的装置中反应,一段时间后在蒸馏烧瓶底得到____色的固体碘。H2O2是一种性能优良的绿色氧化剂可将CuI氧化为I2,本实验不选用H2O2,可能的原因是_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】铝有多种化合物,在工业上用途广泛。氮化铝(AlN)中混有碳和氧化铝,为确定某氮化铝样品的纯度,进行如下实验:(已知:AlN + H2O + NaOH→ NaAlO2 + NH3↑)
(1)称取5.00g样品,加入25mL5mol/L的NaOH溶液,共热,样品中AlN和Al2O3完全反应,测得放出氨气1.68L(标准状况)。该样品中的A1N的质量分数为___________。
(2)过滤上述混合溶液,向滤液中滴加2mol/L的盐酸,当滴至202mL时生成的白色沉淀恰好完全消失,5.00g样品中Al2O3的物质的量是多少摩________?(写出计算过程)
碱式碳酸铝镁[MgxAly(OH)a(CO3)b·nH2O]可做为塑料填料。为确定某碱式碳酸铝镁的组成,进行如下实验:
(3)称取3.390g样品与足量稀盐酸充分反应,生成二氧化碳0.560L(标准状况)。3.390g样品中含CO32―________g。
(4)另取100.00g样品在空气中加热,固体质量随温度的变化如图所示(样品在270℃时已完全失去结晶水,600℃以上固体为金属氧化物的混合物)。
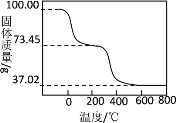
(i)100.00g样品中含结晶水_______mol。
(ii)100.00g样品中OH―的物质的量是多少_______?(写出计算过程)
(iii)通过计算推测该碱式碳酸铝镁的化学式_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】磷有多种化合物,次磷酸(H3PO2)和次磷酸钠(NaH2PO2)常为化工生产中的还原剂。完成下列填空:
(1)H3PO2是一元中强酸,写出其电离方程式:_______;请将NaH2PO2溶液中的各离子按浓度由大到小的顺序排列:__________。
(2)室温下0.1mol/L的NaH2PO2溶液和0.1mol/L的Na2CO3溶液,pH更大的是_______,其原因是__________。
(3)化学镀银,可利用H3PO2把溶液中的Ag+还原为银的反应,已知该反应中还原剂与氧化剂的物质的量之比为1:4,则氧化产物是_______(填化学式)。
(4)工业上可用白磷(P4)与Ba(OH)2溶液反应生成PH3和Ba(H2PO2)2。写出并配平该反应的化学方程式________,若反应中转移电子6NA,用去还原剂_____mol。再向Ba(H2PO2)2溶液中加入盐酸制备H3PO2,有人说应该用硫酸代替盐酸,请说明用硫酸代替盐酸的优点:_______。
(5)下图是利用电解原理制备H3PO2的示意图(阳离子交换膜和阴离子交换膜分别只允许阳、阴离子通过;已知电极反应为:

阳极 4OH--4e→O2↑+ H2O
阴极 2H+ + 2e→H2↑):
分析在阳极室得到H3PO2原因:_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】海水是资源宝库,蕴藏着丰富的化学元素,如氯、溴、碘等。完成下列填空:
(1)氯离子原子核外有_____种不同运动状态的电子、有____种不同能量的电子。
(2)溴在周期表中的位置_________。
(3)卤素单质及其化合物在许多性质上都存在递变规律,请说明下列递变规律的原因。
① 熔点按F2、Cl2、Br2、I2的顺序依次升高,原因是______________。
② 还原性按Cl—、Br—、I—的顺序依次增大,原因是____________。
(4)已知X2 (g) + H2 (g)![]() 2HX (g) + Q(X2 表示Cl2、Br2),如图表示上述反应的平衡常数K与温度T的关系。
2HX (g) + Q(X2 表示Cl2、Br2),如图表示上述反应的平衡常数K与温度T的关系。

① Q表示X2 (g)与H2 (g)反应的反应热,Q_____0(填“>”、“<”或“=”)。
② 写出曲线b表示的平衡常数K的表达式,K=______(表达式中写物质的化学式)。
(5)(CN)2是一种与Cl2性质相似的气体,在(CN)2中C显+3价,N显-3价,氮元素显负价的原因_________,该分子中每个原子都达到了8电子稳定结构,写出(CN)2的电子式_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】NO、NO2可被氨水溶液吸收(6NO+ 4NH3→5N2+6H2O;6NO2+ 8NH3→7N2+12H2O)。现有NO与NO2(不含N2O4)混合气体90mol被30%的氨水4.45×103g完全吸收,产生78mol氮气。吸收后氨水密度为0.980 g/cm3。则
A.原混合气体的平均组成为NO1.1B.原氨水的浓度约为17.3mol/L
C.吸收后氨水的浓度约为2.4mol/LD.吸收后氨水的质量分数约为0.5
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求填空:
(1)将过量的氨水加入氯化铝溶液的离子方程式_____;
(2)浓硝酸久置后会略显黄色,可用方程式表示为_____;
(3)用KOH作电解质溶液,氢氧燃料电池负极反应式为_____;
(4)用方程式表示氯化铵溶液呈酸性原因_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com