
科目: 来源: 题型:
【题目】根据下图,下列判断中正确的是

A.石墨与O2生成CO2的反应是吸热反应
B.等量金刚石和石墨完全燃烧,金刚石放出热量更多
C.从能量角度看,金刚石比石墨更稳定
D.C(金刚石,s) = C(石墨,s) + Q kJ Q= E3—E2
查看答案和解析>>
科目: 来源: 题型:
【题目】以下是一些物质的熔沸点数据(常压):
钾 | 钠 | Na2CO3 | 金刚石 | 石墨 | |
熔点(℃) | 63.65 | 97.8 | 851 | 3550 | 3850 |
沸点(℃) | 774 | 882.9 | 1850(完全分解产生CO2) | --- | 4250 |
金属钠和CO2在常压、890℃发生如下反应:4Na(g)+3CO2(g) ![]() 2Na2CO3(1)+C(s,金刚石);△H= —1080.9 kJ/mol
2Na2CO3(1)+C(s,金刚石);△H= —1080.9 kJ/mol
(1)上述反应的平衡常数表达式为________________;若4v正(Na)=3v逆(CO2),反应是否达到平衡________ (选填“是”或“否”)。
(2)若反应在10L密闭容器、常压下进行,温度由890℃升高到1860℃,若反应时间为10min,金属钠的物质的量减少了0.2mol,则10min里CO2的平均反应速率为________________。
(3)高压下有利于金刚石的制备,理由_____________________________________________。
(4)由CO2(g)+4Na(g)=2Na2O(s)+C(s,金刚石) △H= —357.5kJ/mol;则Na2O固体与C(金刚石)反应得到Na(g)和液态Na2CO3(1)的热化学方程式:___________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】电离平衡常数(Ka、Kb)、水的离子积常数(Kw)、盐的水解常数(Kh)是电解质溶液中的三大常数,学习中我们要注意他们的区别与联系,通过学习的相关知识请完成以下练习。
(1)已知:a.常温下,醋酸和NH3H2O的电离常数相同。
b.CH3COOH+NaHCO3═CH3COONa+CO2↑+H2O
①CH3COONH4溶液呈_______性(填"酸"、"碱"或"中",下同)。
②NH4HCO3溶液呈________性,溶液中物质的量浓度最大的离子是______(填化学式)。
(2)室温时,若用盐酸滴定氨水,当滴定过程中pH=9时,且溶液中满足4c(NH4+)=7c(NH3·H2O),则氨水的电离平衡常数Kb(NH3·H2O)=____________(填数值)。
(3)100℃时,Kw=1.0×10-12,该温度下测得0.1mol/L Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为__________________________________
②该温度下,将0.01mol/L H2A 溶液稀释20倍后,溶液的pH=__________
(4)已知常温下CN-的水解常数Kh=1.61×10-5。常温下,含等物质的量浓度的HCN与NaCN的混合溶液显______(填“酸”、“碱”或“中”)性,c(CN-)_____(填“>”、“<”或“=”)c(HCN)。
学法题:就以上的解答思考,电离平衡常数(Ka)、水的离子积常数(Kw)、盐的水解常数(Kh)之间有什么关系,请写出他们的关系式____________
查看答案和解析>>
科目: 来源: 题型:
【题目】天然气脱硫的方法有多种,一种是干法脱硫,其涉及的反应:H2(g)+CO(g)+SO2(g)![]() H2O(g)+CO2(g)+S(s)+Q(Q>0)。要提高脱硫率可采取的措施是
H2O(g)+CO2(g)+S(s)+Q(Q>0)。要提高脱硫率可采取的措施是
A.加催化剂B.分离出硫C.减压D.加生石灰
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图示与对应的叙述相符的是
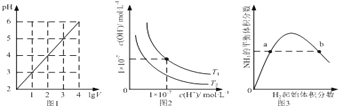

A.图1表示1 L pH=2的CH3COOH溶液加水稀释至V L,pH随lgV的变化
B.图2表示不同温度下水溶液中H+和OH﹣浓度的变化的曲线,图中温度T2>T1
C.图3表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中b点N2的转化率小于a点
D.图4表示同一温度下,在不同容积的容器中进行反应2BaO2(s)![]() 2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作、现象与结论对应关系正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向盛有Fe(NO3)2溶液的试管中加入0.1 mol·L-1H2SO4溶液 | 试管口出现红棕色气体 | 溶液中NO |
B | 向2 mL 1 mol/L NaOH溶液中先加入3滴1 mol/L MgCl2溶液,再加入3滴1 mol/L FeCl3溶液 | 先出现白色沉淀后又生成红褐色沉淀 | 证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 |
C | 在滴有酚酞的Na2CO3溶液中, 加入BaC12 | 溶液红色褪去 | CO32-在溶液中存在水解平衡 |
D | 常温下,测定盐酸和醋酸溶液的pH | 盐酸pH小于醋酸pH | 证明相同条件下,在水中HCl电离程度大于CH3COOH |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上采用氨的催化氧化制备硝酸,其反应如下:
4NH3+5O2→4NO+6H2O
4NO+3O2+2H2O→4HNO3
设空气中氧气的体积分数为0.20,氮气的体积分数为0.80
(1)为使NH3恰好完全氧化为NO,氨﹣空气混合物中氨的体积分数为______
(2)1mol NH3完全转化HNO3,若在此过程中不补充水,则所得HNO3溶液的质量分数为______(保留2位小数)
(3)已知NH3完全转化NO的转化率为95%,由NO转化HNO3的转化率为92%.请计算用17吨NH3可制取质量分数为0.63的硝酸溶液______________吨?
(4)硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:
2NO2+Na2CO3→NaNO2+NaNO3+CO2↑ ①
NO+NO2+Na2CO3→2NaNO2+CO2↑ ②
若每生成1mol CO2,吸收溶液质量就增加40g.计算吸收液中NaNO2和NaNO3物质的量之比______________.
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是某同学研究铜与浓硫酸的反应装置:
完成下列填空:
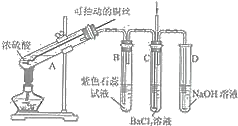
(1)写出A中发生反应的化学方程式______,采用可抽动铜丝进行实验的优点是______。
(2)反应一段时间后,可观察到B试管中的现象为______。
(3)从C试管的直立导管中向BaCl2溶液中通入另一种气体,产生白色沉淀,则气体可以是______、______.(要求填一种化合物和一种单质的化学式)。
(4)反应完毕,将A中的混合物倒入水中,得到呈酸性的蓝色溶液与少量黑色不溶物,分离出该不溶物的操作是______,该黑色不溶物不可能是CuO,理由是______。
(5)对铜与浓硫酸反应产生的黑色不溶物进行探究,实验装置及现象如下:
实验装置 | 实验现象 |
| 品红褪色 |
①根据实验现象可判断黑色不溶物中一定含有______元素。
②若该黑色不溶物由两种元素组成且在反应前后质量保持不变,推测其化学式为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】普通电解精炼铜的方法所制备的铜中仍含杂质,利用下面的双膜( 阴离子交换膜和过滤膜)电解装置可制备高纯度的Cu。下列有关叙述正确的是

A. 电极a为粗铜,电极b为精铜
B. 甲膜为过滤膜,可阻止阳极泥及漂浮物杂质进入阴极区
C. 乙膜为阴离子交换膜,可阻止杂质阳离子进入阴极区
D. 当电路中通过1mol电子时,可生成32g精铜
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,将 1.0 L w mol·L-1 CH3COOH 溶液与 0.1 mol NaOH固体混合,充分反应。然后向混合液中加入CH3COOH或CH3COONa固体(忽略体积和温度变化),溶液pH的变化如图。下列叙述正确的是
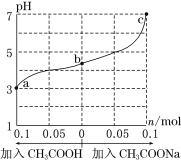
A.b点混合液中c(Na+)>c(CH3COO-)
B.加入CH3COOH过程中,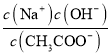 增大
增大
C.c点存在:c(CH3COOH)+c(CH3COO-) =0.1+w
D.a、b、c对应的混合液中,水的电离程度由大到小的顺序是c>a>b
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com