
科目: 来源: 题型:
【题目】已知:25 ℃时,CH3COOH和NH3·H2O的电离常数相等。
(1)25 ℃时,取10 mL 0.1 mol·L-1醋酸溶液测得其pH=3。
①将上述(1)溶液加水稀释至1 000 mL,溶液pH数值范围为___________,溶液中c(CH3COO-)/[c(CH3COOH)·c(OH-)]___________(填“增大”“减小”“不变”或“不能确定”)。
②25 ℃时,0.1 mol·L-1氨水(NH3·H2O溶液)的pH=___________。用pH试纸测定该氨水pH的操作方法为_______________________________________________________。
③氨水(NH3·H2O溶液)电离平衡常数表达式Kb=_______________________________,25 ℃时,氨水电离平衡常数约为___________。
(2)25 ℃时,现向10 mL 0.1 mol·L-1氨水中滴加相同浓度的CH3COOH溶液,在滴加过程中c(NH4+)/c(NH3.H2O)___________(填序号)。
a.始终减小 b.始终增大 c.先减小再增大 d.先增大后减小
(3)某温度下,向V1mL 0.1 mol·L-1NaOH溶液中逐滴加入等浓度的醋酸溶液,溶液中pOH与pH的变化关系如图。已知:pOH=- lgc(OH-)。

图中M、Q、N三点所示溶液呈中性的点是___________(填字母,下同)。
图中M、Q、N三点所示溶液中水的电离程度最大的点可能是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】黄铜矿、辉铜矿、斑铜矿等是工业炼铜的常用原料。完成下列计算:
(1)某种黄铜矿中铜的质量分数为0.25,生产1吨纯铜理论上需要这种铜矿_______吨。
(2)实验室以黄铜矿为原料模拟工业炼铜时会产生SO2,用200 mL 1 mol/L的NaOH溶液吸收后,将溶液低温蒸干,得到不含结晶水的固体19.98 g,求所得固体的成分及物质的量。__________
(3)斑铜矿的主要成分M由Cu、Fe、S三种元素组成,其中Cu、Fe元素的质量比为40∶7。常温下将5.04 g M粉末全部溶于过量浓HNO3中,反应后的溶液加水稀释至500 mL,测得其pH=0。向溶液中滴加5 mol/L的NaOH溶液,当加入126 mL后,沉淀质量不再增加,求M的化学式。__________
(4)以辉铜矿为原料火法炼铜,其原理是:
2Cu2S+3O2 → 2Cu2O+2SO2; Cu2S+2Cu2O → 6Cu+SO2↑。
将含3 mol Cu2S的辉铜矿与一定量的空气(氮气、氧气的体积比为4:1)在密闭容器中充分反应(假设各步反应都完全),得到单质铜3 mol,求所得气体中SO2的体积分数。__________
查看答案和解析>>
科目: 来源: 题型:
【题目】I.硝酸钾用途广泛,工业上一般用复分解反应制取硝酸钾(相关物质的溶解度曲线见表)。以硝酸钠和氯化钾为原料制备硝酸钾的工艺流程如下:
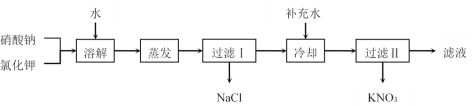

完成下列填空:
(1)为了加速固体溶解,可采取的措施有__________(至少写两种);实验室进行蒸发结晶操作时,为了防止液滴飞溅,进行的操作是_____________。
(2)过滤I所得滤液中含有的离子是________;过滤I所得滤液在进行冷却结晶前应补充少量水,目的是______________。
(3)检验产品KNO3中杂质的方法是________________。
II.实验室模拟工业上用氯化钾和硝酸铵为原料制取硝酸钾的过程如下:
取40 g NH4NO3和37.25 g KCl固体加入100 g水中,加热至90℃,固体溶解, 用冰水浴冷却至5℃以下,过滤(a)。在滤液中再加入NH4NO3,加热蒸发,当体积减小到约原来的![]() 时,保持70℃过滤(b),滤液可循环使用。完成下列填空:
时,保持70℃过滤(b),滤液可循环使用。完成下列填空:
(4)过滤(a)得到的固体物质主要是__________;在滤液中再加入NH4NO3的目的是________________________。
(5)为检测硝酸钾样品中铵盐含量,称取1.564 g样品,加入足量的NaOH浓溶液,充分加热,生成的气体用20.00 mL 0.102 mol/L H2SO4溶液全部吸收,滴定过量的H2SO4用去0.089 mol/L标准NaOH溶液16.55 mL。滴定过程中使用的指示剂是________;样品中含铵盐(以氯化铵计)的质量分数是___________(保留3位小数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】乙醇是制取饮料、香精、染料、涂料、洗涤剂等产品的原料。

完成下列填空:
(1)实验室用乙醇制取乙烯时,浓硫酸的用量远远超过作为催化剂的正常用量,原因是______。
(2)验证乙烯加成反应性质时,需对乙烯气体中的干扰物质进行处理,可选用的试剂是_____(填写化学式);能确定乙烯通入溴水中发生了加成反应的事实是______。(选填编号)
a.溴水褪色 b.有油状物质生成
c.反应后水溶液酸性增强 d.反应后水溶液接近中性
(3)实验室用乙醇和乙酸制备乙酸乙酯时,甲、乙两套装置如图1都可以选用。关于这两套装置的说法正确的是______。(选填编号)

a.甲装置乙酸转化率高 b.乙装置乙酸转化率高
c.甲装置有冷凝回流措施 d.乙装置有冷凝回流措施
(4)用乙装置实验时,提纯乙中乙酸乙酯的流程如图3以上流程中试剂A的化学式是______;操作Ⅱ的名称是______;操作Ⅲ一般适用于分离______混合物。
(5)如图2是用乙醇制备溴乙烷的装置,实验中有两种加料方案:
①先加溴化钠→再加乙醇→最后加1:1浓硫酸;
②先加溴化钠→再加1:1浓硫酸→最后加乙醇。
按方案①和②实验时,产物都有明显颜色,若在试管中加入______,产物可变为无色。与方案①相比较,方案②的明显缺点是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室制乙酸乙酯得主要装置如图中A所示,主要步骤①在a试管中按2:3:2的体积比配制浓硫酸、乙醇、乙酸的混合物;②按A图连接装置,使产生的蒸气经导管通到b试管所盛的饱和碳酸钠溶液(加入几滴酚酞试液)中;③小火加热a试管中的混合液;④等b试管中收集到约2mL产物时停止加热.撤下b试管并用力振荡,然后静置待其中液体分层;⑤分离出纯净的乙酸乙酯。
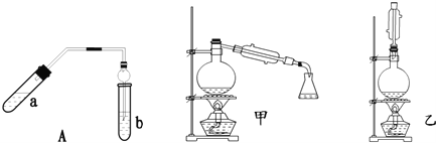
请回答下列问题:
(1)步骤①中,配制这一比例的混合液的正确操作是__;
(2)若实验中用含18O的乙醇与乙酸作用,该反应得化学方程式是:__;
(3)步骤③中,要用小火加热,其原因是__;
(4)步骤④中可观察到b试管中有细小的气泡冒出,写出该反应的离子方程式:__;
(5)A装置中使用球形管除起到冷凝作用外,另一重要作用是__,步骤⑤中分离乙酸乙酯必须使用的一种仪器是__;
(6)为充分利用反应物,甲、乙两位同学分别设计了图中甲、乙两个装置(乙同学待反应完毕冷却后,再用饱和碳酸钠溶液提取烧瓶中的产物),你认为合理的是__。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于苯的叙述正确的是( )
A.苯的分子式为C6H6,它不能使酸性KMnO4溶液褪色,属于饱和烃
B.从苯的凯库勒式(![]() )看,苯分子中含有碳碳双键,应属于烯烃
)看,苯分子中含有碳碳双键,应属于烯烃
C.在催化剂作用下,苯与液溴反应生成溴苯,发生了加成反应
D.苯分子为平面正六边形结构,6个碳原子之间的价键完全相同
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与生产、生活密切相关,下列叙述正确的是( )
A. 淀粉、油脂和蛋白质都是天然高分子化合物
B. 葡萄糖注射液不能产生丁达尔效应现象,不属于胶体
C. 14C可用于文物年代的鉴定,14C与12C互为同素异形体
D. 从海水中可以得到NaCl,电解饱和NaCl溶液可以得到金属Na
查看答案和解析>>
科目: 来源: 题型:
【题目】自来水生产过程中,可用氯气等物质作消毒剂,明矾等物质作絮凝剂。出厂的自来水中含少量可溶性矿物质。完成下列填空:
(1)自来水中含硫量约70 mg/L,它只能以______(填微粒符号)形态存在,不能以其它形态存在的原因是________________________。
(2)已知在碱性条件下,氯气会发生自身氧化还原反应,某反应体系中的物质为:KClO3、Cl2、KCl、KOH、H2O。
①写出该反应的化学方程式。____________________________。
②该反应中氧化剂与还原剂的质量比为_________。
(3)实验室利用反应6HCl+KClO3 → KCl+3H2O+3Cl2↑制取Cl2,当产生标准状况下的气体3.36 L时,转移电子_____mol。
(4)不同环境中,物质的性质可能会有所不同。根据上述两题的反应中KClO3和Cl2的氧化性强弱比较,你能得出的结论是________________________。
(5)铝铵矾[NH4Al(SO4)212H2O]也是常用的工业净水剂,其净水的化学原理是________________(用离子方程式表示)。
(6)在向铝铵矾溶液中逐滴滴加氢氧化钡溶液的过程中,下列关系可能正确的是_________。(选填编号)
a.n(SO42-)>n(NH4+)>n(A13+)>n(OH-)
b.n(A13+)>n(NH4+)>n(SO42-)>n(H+)
c.n(BaSO4)>n[A1(OH)3]>n(NH3·H2O)>n(A1O2-)
d.n(NH3·H2O)>n(BaSO4)>n[A1(OH)3]>n(A1O2-)
查看答案和解析>>
科目: 来源: 题型:
【题目】I.焦炭可用于制备电石、生产水煤气等。完成下列填空:
(1)电石的主要成分是CaC2,CaC2的晶体类型是___________;其与水反应的化学方程式为______________________。
(2)制备电石还需要用到CaCO3。组成CaCO3的三种元素原子半径按从大到小的顺序排列为____________。氧原子的核外电子排布式为_________________。
(3)与同主族元素Mg相比,Ca的金属性更______(填“强”或者“弱”)。能证明这一结论的实验事实是________________________。
II.用焦炭生产水煤气的反应为:C(s)+H2O(g)![]() CO(g)+H2(g)。完成下列填空:
CO(g)+H2(g)。完成下列填空:
(4)一定温度下,在一个固定容积的密闭容器中发生上述反应,下列不能判断该反应达到平衡状态的是____________。(选填编号)
a.容器中的压强不再改变 b.混合气体的密度不再改变
c.v正(CO)=v逆(H2O) d.c(CO)=c(H2)
(5)将不同量的C (s)和H2O (g)分别加入到体积为2 L的恒容密闭容器中,进行反应,得到如下数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
H2O | C | H2 | CO | |||
1 | 650 | 0.01 | 0.02 | 0.008 | 5 | |
2 | 800 | 0.02 | 0.03 | 0.017 | 3 | |
①实验1中以v(H2) 表示的到达平衡时的平均反应速率为____________。
②下列图像正确的是________。(选填编号)
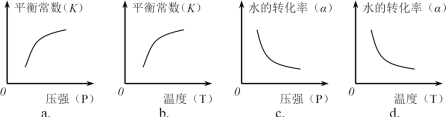
查看答案和解析>>
科目: 来源: 题型:
【题目】在一固定容积的密闭容器中,充入2 mol A和1 mol B发生如下反应:2A(g)+B(g) ![]() xC(g),达到平衡后,C的体积分数为w%;若维持容器体积和温度不变,以0.6 mol A、0.3 mol B和1.4 mol C为起始物质,达到平衡后,C的体积分数也为w%,则x的值为
xC(g),达到平衡后,C的体积分数为w%;若维持容器体积和温度不变,以0.6 mol A、0.3 mol B和1.4 mol C为起始物质,达到平衡后,C的体积分数也为w%,则x的值为
A.5 B.4 C.3 D.1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com