
科目: 来源: 题型:
【题目】异丁烯[CH2=C(CH3)2]是重要的化工原料。
已知:![]()
(1)异丁烯和苯酚在一定条件下反应生成对叔丁基酚(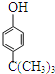 ),该反应属于_________反应(填“反应类型”).
),该反应属于_________反应(填“反应类型”).
(2)对叔丁基酚和甲醛在催化剂作用下可生成油溶性聚合物,写出该反应的化学方程式________________。
(3)写出符合下列条件的对叔丁基酚的所有同分异构体的结构简式________________________________。
①含相同官能团;②不属于酚类;③苯环上的一溴代物只有一种。
(4)已知由异丁烯的一种同分异构体A,经过一系列变化可合成物质,其合成路线如图:
![]()
①条件1为_____________;
②写出结构简式:A_____________;B____________。
(5)异丁烯可二聚生成CH2=C(CH3)CH2C(CH3)3,写出该二聚物的名称__________。异丁烯二聚时,还会生成其他的二聚烯烃类产物,写出其中一种链状烯烃的结构简式________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列化学用语,应用正确的是 ( )
A.硝基苯的结构简式是:![]()
B.乙炔的电子式是:![]()
C.乙醚分子的球棍模型是: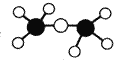
D.甲酸中存在一CHO和—COOH两种官能团
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用燃烧法测定某种氨基酸(CxHyOzNm)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气。按下图所示装置进行实验。

回答下列问题:
(1)实验开始时,首先通入一段时间的氧气,其理由是__________________。
(2)以上装置中需要加热的仪器有_______ (填写字母),操作时应先点燃_____处的酒精灯。
(3)A装置中发生反应的化学方程式是____________________________。
(4)D装置的作用是____________________________。
(5)读取氮气的体积时,应注意①_________________;②_________________。
(6)实验中测得氮气的体积为VmL(标准状况),为确定此氨基酸的分子式,还需要的有关数据有____________________。
A.生成二氧化碳气体的质量
B.生成水的质量
C.通人氧气的体积
D.氨基酸的相对分子质量
查看答案和解析>>
科目: 来源: 题型:
【题目】影响化学反应速率的因素很多,某课外兴趣小组用实验方法进行探究。
(1)取等物质的量浓度、等体积的H2O2溶液分别进行H2O2的分解实验,实验报告如下表所示(现象和结论略)。

①实验1、2研究的是__________对H2O2分解速率的影响。
②实验2、3的目的是_______________对H2O2分解速率的影响。
(2)查文献可知,Cu2+对H2O2分解也有催化作用,为比较Fe3+、Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:

①定性如图甲可通过观察_______,定性比较得出结论。有同学提出将CuSO4溶液改为CuCl2溶液更合理,其理由是_________。
②定量如图乙所示,实验时以收集到40 mL气体为准,忽略其他可能影响实验的因素,实验中需要测量的数据是__________。
(3)酸性高锰酸钾溶液和草酸溶液可发生反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,实验时发现开始反应速率较慢,溶液褪色不明显,但一段时间后突然褪色,反应速率明显加快。对此展开讨论:
①某同学认为KMnO4与H2C2O4的反应是______热反应,导致_______________;
②从影响化学反应速率的因素看,你认为还可能是________的影响。要证明你的猜想,实验方案是________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学学习小组进行如下实验。
【探究反应速率的影响因素】设计了如下的方案并记录实验结果(忽略溶液混合体积变 化)。限选试剂和仪器:0.20mol/LH2C2O4 溶液、0.010mol/L KMnO4 溶液(酸性)、蒸馏水、 试管、量筒、秒表、恒温水浴槽
(1)上述实验①②是探究 对化学反应速率的影响;若上述实验②③是探究浓度对化学反应速率的影响,则 a 为 ;乙是实验需要测量的物理量,则表 格中“乙”应填写 。
【测定 H2C2O4·xH2O 中 x 值】 已知:M(H2C2O4)=90g/mol
称取 1.260 g 纯草酸晶体,将其酸制成 100.00 mL 水溶液为待测液。
②取 25.00 mL 待测液放入锥形瓶中,再加入适的稀 H2SO4
③用浓度为 0.05000 mol·L-1 的 KMnO 标准溶液进行滴定;
(2)请写出与滴定有关反应的离子方程式
(3)某学生的滴定方式(夹持部分略去)如下,最合理的是 (选填 a、b)。


(4)由右图可知消耗 KMnO4 溶液体积为 mL;
(5)滴定过程中眼睛应注视_________________;
(6)通过上述数据,求得 x= 。以标准 KMnO4 溶液滴定样品溶液的浓度,未用 标准 KMnO4 溶液润洗滴定管,引起实验结果 (偏大、偏小或没有影响)。
查看答案和解析>>
科目: 来源: 题型:
【题目】我国是镁资源最为丰富的国家之一.
(1)将1mol镁铝合金(Mg17Al12)完全溶解于12L 6mol/L的盐酸中,放出氢气______mol,为使反应后溶液中的Mg2+、Al3+完全沉淀,需加入10mol/L的氨水至少______L。
(2)灼烧碱式碳酸镁可得到MgO.取碱式碳酸镁4.66g,灼烧至恒重,得到2g固体和1.76g CO2,某学生为确定碱式碳酸镁的化学式列了以下联立方程:
24+17x+60y+18z=4.66÷(![]() )…①
)…①
2﹣x﹣2y=0…②
(![]() )×(0.5x+z)×18=4.66﹣2﹣1.76…③
)×(0.5x+z)×18=4.66﹣2﹣1.76…③
(a)①式表达的是求算碱式碳酸镁摩尔质量的关系式,则②式表达的是_______________;
(b)以上关系式是正确的,据此可求出该碱式碳酸镁的化学式为________________________________。
(3)氧化镁可用于烟气脱硫,反应原理为:
MgO+H2O=Mg(OH)2 Mg(OH)2+SO2=MgSO3+H2O
MgSO3+H2O+SO2=Mg(HSO3)2 2MgSO3+O2=2MgSO4
某小组模拟脱硫过程如下(实验在25℃进行):将MgO加入水中,不断搅拌,通入SO2和空气,得到550g滤液和若干克滤渣.取55g滤液依次加入足量的盐酸和BaCl2溶液,得到0.897g白色沉淀;另取55g滤液加入足量氯水和BaCl2混合溶液,得到1.992g白色沉淀.分析知滤渣中含MgSO3 16.82g(其它成分不含硫元素)。
①该实验过程中吸收的SO2的物质的量为________mol;消耗氧气的物质的量为_______mol。
②Mg(HSO3)2易溶于水;25℃溶解度,MgSO4:33.7g/100g水;MgSO3:0.652g/100g水.试通过计算确定550g滤液中镁盐的成分及物质的量(写出计算过程)___________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】最近科学家获得了一种稳定性好、抗氧化能力强的活性化合物A;其结构如下:
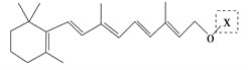
为了研究X的结构,将化合物A在一定条件下水解只得到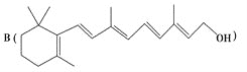 和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
请回答下列问题:
(1)化合物B能发生下列哪些类型的反应________。
A.取代反应 B.加成反应
C.缩聚反应 D.氧化反应
(2)写出化合物C所有可能的结构简式______________________________。
(3)C可通过下图所示途径合成,并制取冬青油和阿司匹林。

(ⅰ)写出有机物的结构简式:D:______________,C:________________,E:______________。
(ⅱ)写出变化过程中①、⑥的化学方程式(注明反应条件)
反应①__________________________________;反应⑥_____________________________。
(ⅲ)变化过程中的②属于____________反应,⑦属于________反应。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)具有较强的还原性,还能与中强酸反应,在精细化工领域应用广泛.将SO2通入按一定比例配制成的Na2S和Na2CO3的混合溶液中,可制得Na2S2O35H2O(大苏打).
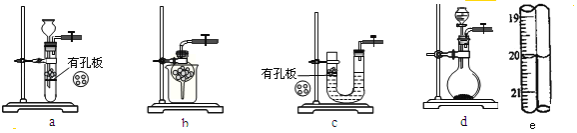
(1)实验室用Na2SO3和硫酸制备SO2,可选用的气体发生装置是_____(选填编号);检查该装置气密性的操作是:关闭止水夹,再_______________。
(2)在Na2S和Na2CO3的混合溶液中不断通入SO2气体的过程中,发现:
①浅黄色沉淀先逐渐增多,反应的化学方程式为________________(生成的盐为正盐);
②浅黄色沉淀保持一段时间不变,有无色无嗅的气体产生,则反应的化学方程式为__________________(生成的盐为正盐);
③浅黄色沉淀逐渐减少(这时有Na2S2O3生成);
④继续通入SO2,浅黄色沉淀又会逐渐增多,反应的化学方程式为_______________(生成的盐为酸式盐)。
(3)制备Na2S2O3时,为了使反应物利用率最大化,Na2S和Na2CO3的物质的量之比应为_________;通过反应顺序,可比较出:温度相同时,同物质的量浓度的Na2S溶液和Na2CO3溶液pH更大的是_________。
(4)硫代硫酸钠的纯度可用滴定法进行测定,原理是:2S2O32﹣+I3﹣=S4O62﹣+3I﹣.
①为保证不变质,配制硫代硫酸钠溶液须用新煮沸并冷却的蒸馏水,其理由是___________。
②取2.500g含杂质的Na2S2O35H2O晶体配成50mL溶液,每次取10.00mL用0.0500mol/L KI3溶液滴定(以淀粉为指示剂),实验数据如下(第3次初读数为0.00,终点读数如图e;杂质不参加反应):
编号 | 1 | 2 | 3 |
消耗KI3溶液的体积/mL | 19.98 | 20.02 |
到达滴定终点的现象是_______________;Na2S2O35H2O(式量248)的质量分数是(保留4位小数)__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)糖类、油脂、蛋白质和维生素都是人类的基本营养物质,下表为某品牌燕麦片标签中的一部分。
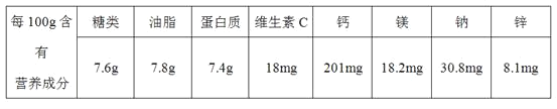
该燕麦片的营养成分中,能与水反应生成氨基酸的营养物质是_________,每克营养物质氧化时放出能量最多的是_________,一般营养、健康类杂志中提到的“碳水化合物”是指_________,人体必需的微量元素是_________;
(2)维生素C易溶于水,向其水溶液中滴入紫色石蕊试液,石蕊变红色,加热该溶液至沸腾,红色消失,因此,烹调富含维生素C的食物时,应该注意_________;在碱性条件下,维生素C易被空气氧化,烧煮时最好加一点_________;
(3)我们穿的衣服通常是由纤维织成的,常见的纤维有棉花、羊毛、涤纶等.用灼烧法可初步鉴别三种纤维,给三种纤维编号后,分别灼烧产生的气味如下:

则羊毛的编号为_________,棉花的编号为_________,涤纶的编号为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:25 ℃时,CH3COOH和NH3·H2O的电离常数相等。
(1)25 ℃时,取10 mL 0.1 mol·L-1醋酸溶液测得其pH=3。
①将上述(1)溶液加水稀释至1 000 mL,溶液pH数值范围为___________,溶液中c(CH3COO-)/[c(CH3COOH)·c(OH-)]___________(填“增大”“减小”“不变”或“不能确定”)。
②25 ℃时,0.1 mol·L-1氨水(NH3·H2O溶液)的pH=___________。用pH试纸测定该氨水pH的操作方法为_______________________________________________________。
③氨水(NH3·H2O溶液)电离平衡常数表达式Kb=_______________________________,25 ℃时,氨水电离平衡常数约为___________。
(2)25 ℃时,现向10 mL 0.1 mol·L-1氨水中滴加相同浓度的CH3COOH溶液,在滴加过程中c(NH4+)/c(NH3.H2O)___________(填序号)。
a.始终减小 b.始终增大 c.先减小再增大 d.先增大后减小
(3)某温度下,向V1mL 0.1 mol·L-1NaOH溶液中逐滴加入等浓度的醋酸溶液,溶液中pOH与pH的变化关系如图。已知:pOH=- lgc(OH-)。

图中M、Q、N三点所示溶液呈中性的点是___________(填字母,下同)。
图中M、Q、N三点所示溶液中水的电离程度最大的点可能是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com