
科目: 来源: 题型:
【题目】一定温度下,水存在H2O![]() H++OH--Q的平衡,下列叙述一定正确的是( )
H++OH--Q的平衡,下列叙述一定正确的是( )
A.向水中滴入少量稀盐酸,平衡逆向移动,Kw减小
B.将水加热,Kw增大,pH减小
C.向水中加入少量固体NH4Cl,平衡逆向移动,c(H+)降低
D.向水中加入少量固体硫酸钠,c(H+)=10-7mol/L,Kw不变
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关叙述正确的是( )

A. 如图所示,测定中和热时,大小两烧杯间填满碎纸条或泡沫塑料的目的是固定小烧杯
B. 若用50 mL 0.55 mol·L-1的氢氧化钠溶液,分别与50 mL 0.50 mol·L-1的盐酸和50 mL 0.50 mol·L-1的硫酸充分反应,两反应测定的中和热不相等
C. 为了简化装置,中和热测定实验中的环形玻璃搅拌棒可以由温度计代替
D. 中和热测定实验也可以用稀硫酸与氢氧化钠溶液反应
查看答案和解析>>
科目: 来源: 题型:
【题目】稀土是一种重要的战略资源。氟碳铈矿主要化学成分为CeFCO3,它是提取铈等稀土元素的重要矿物原料。氟碳铈矿的冶炼工艺流程如下:
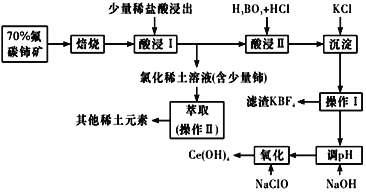
已知:铈的常见化合价为+3、+4。焙烧后铈元素转化成CeO2和CeF4。四价铈不易进入溶液,而三价稀土元素易进入溶液;
酸浸II中发生反应:
9CeO2+3CeF4+45HCl+3H3BO3=Ce(BF4)3↓+11CeCl3+6Cl2↑+27H2O;c(Ce3+)≤10-5 mol/L 时,完全沉淀。
请回答下列问题:
(1)①焙烧时先要将氟碳C矿粉碎,目的是 ___________。
②焙烧后产生的CeO2是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧。在尾气消除过程中发生着CeO2![]() CeO2(1-x)+xO2↑的循环。写出CeO2消除CO尾气的化学方程式:________。
CeO2(1-x)+xO2↑的循环。写出CeO2消除CO尾气的化学方程式:________。
(2)在酸浸I中用盐酸浸出时,有少量铈进入滤液,且产生黄绿色气体。 少量铈由CeO2进入稀土溶液发生反应的离子方程式是_______。
(3)向Ce(BF4)3中加入KCl溶液的目的是_________。
(4)操作I的名称为_________,在实验室中进行操作II时所需要的硅酸盐仪器有_______。
(5)“操作I”后,向溶液中加入NaOH溶液来调节溶液的pH,以获得Ce(OH)3沉淀,常温下加入NaOH调节溶液的 pH应大于______即可认为Ce3+已完全沉淀。{已知:Ksp[Ce(OH)3]=1.0 ×10-20}
(6)取上述流程中得到的Ce(OH)4产品5.00g,加酸溶解后,向其中加入含0.033 00 mol FeSO4的FeSO4溶液使Ce4+全部被还原成Ce3+,再用0.100 0mol/L的酸性KMnO4标准溶液滴定至终点时,平均消耗20.00 mL标准溶液。则该产品中Ce(OH)4的质量分数为______(保留2位小数,已知氧化性:Ce4+ >KMnO4;Ce(OH)4 的相对分子质量为208)
查看答案和解析>>
科目: 来源: 题型:
【题目】某学习小组对人教版教材实验“在200mL烧杯中放入20g蔗糖(C12H22O11),加入适量水,搅拌均匀,然后再加入15mL质量分数为98%浓硫酸,迅速搅拌”进行如下探究;
(1)观察现象:蔗糖先变黄,再逐渐变黑,体积膨胀,形成疏松多孔的海绵状黑色物质,同时闻到刺激性气味,按压此黑色物质时,感觉较硬,放在水中呈漂浮状态,同学们由上述现象推测出下列结论:
①浓硫酸具有强氧化性 ②浓硫酸具有吸水性 ③浓硫酸具有脱水性④浓硫酸具有酸性 ⑤黑色物质具有强吸附性
其中依据不充分的是_________(填序号);
(2)为了验证蔗糖与浓硫酸反应生成的气态产物,同学们设计了如下装置:

试回答下列问题:
①图1的A中最好选用下列装置_________(填编号);
②图1的 B装置所装试剂是_________;D装置中试剂的作用是_________;E装置中发生的现象是_________;
③图1的A装置中使蔗糖先变黑的化学反应方程式为_________,后体积膨胀的化学方程式为:_________;
④某学生按图2进行实验时,发现D瓶品红不褪色,E装置中有气体逸出,F装置中酸性高锰酸钾溶液颜色变浅,推测F装置中酸性高锰酸钾溶液颜色变浅的原因_________,其反应的离子方程式是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用燃烧法测定某种氨基酸(CxHyOzNm)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气。按下图所示装置进行实验。

回答下列问题:
(1)实验开始时,首先通入一段时间的氧气,其理由是__________________。
(2)以上装置中需要加热的仪器有_______ (填写字母),操作时应先点燃_____处的酒精灯。
(3)A装置中发生反应的化学方程式是____________________________。
(4)D装置的作用是____________________________。
(5)读取氮气的体积时,应注意①_________________;②_________________。
(6)实验中测得氮气的体积为VmL(标准状况),为确定此氨基酸的分子式,还需要的有关数据有____________________。
A.生成二氧化碳气体的质量
B.生成水的质量
C.通人氧气的体积
D.氨基酸的相对分子质量
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化铜晶体(CuCl2·2H2O)中含有FeCl2杂质,为制得纯净的氯化铜晶体,首先将其制成水溶液,再按下图所示的操作步骤进行提纯。
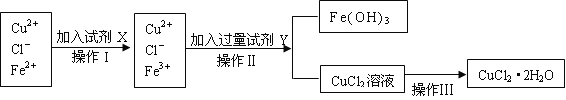
请参照下表给出的数据填空。
氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
Cu2+ | 4.7 | 6.7 |
Fe2+ | 7.0 | 9.0 |
Fe3+ | 1.9 | 3.7 |
(1)操作I加入X的目的是_________________。
(2)下列物质都可以作为X,适合本实验的X物质可以是(填选项)_________ 。
A、KMnO4 B、NaClO C、H2O2 D、Cl2
(3)操作II的Y试剂为____________(填化学式),并调节溶液的pH在______范围。
(4)实验室在配制CuCl2溶液时需加入少许_________(填物质名称),理由是(文字叙述并用有关离子方程式表示)_________________ __________。
(5)若将CuCl2溶液蒸干灼烧,得到的固体是_________________(填化学式);若要得无水CuCl2,请简述操作方法_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图中,甲是电解饱和食盐水,乙是铜的电解精炼,丙是电镀,回答:

(1)b极上的电极反应式为__,甲电池的总反应化学方程式是__。
(2)在粗铜的电解过程中,图中c电极的材料是__(填“粗铜板”或“纯铜板”);在d电极上发生的电极反应为__;若粗铜中还含有Au、Ag、Fe等杂质,则沉积在电解槽底部(阳极泥)的杂质是__,电解一段时间后,电解液中的金属离子有__。
(3)如果要在铁制品上镀镍(二价金属,相对原子质量59),则f电极的材料是__(填“铁制品”或“镍块”,下同),e电极的材料是__。
(4)若e电极的质量变化118 g,则a电极上产生的气体在标准状况下的体积为__。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ. 已知,CO 的毒性表现在 CO 与血红蛋白(Hb)结合成Hb·CO,使血红蛋白失去输送 O2功能。CO进入血液后有如下平衡:CO+Hb·O2![]() O2+Hb·CO,已知在人体体温 37℃下,该平衡常数为 220。试回答:
O2+Hb·CO,已知在人体体温 37℃下,该平衡常数为 220。试回答:
(1)煤气中毒病人,可以通过进入高压氧舱的方法来救治,请用化学平衡的原理加以说明:______。
(2)抽烟时,进入肺部的空气中c(CO)=10-6mol·L-1,c(O2)=10-2mol·L-1,则c(Hb·CO)为c(Hb·O2)的___________倍。
(3)已知当血液中c(Hb·CO)/c(Hb·O2)的比值大于 0.02时,人的智力会很快受到损伤,为避免人的智力受到损伤,c(O2)与c(CO)的比值应大于_____。
Ⅱ.在某一温度条件下, Bodensteins 研究了反应:2HI(g)![]() H2(g) +I2(g),气体混合物中 HI 的物质的量浓度x(HI)(mol·L-1)与反应时间t的关系如下表:
H2(g) +I2(g),气体混合物中 HI 的物质的量浓度x(HI)(mol·L-1)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 | |
第一次试验 | x(HI) | 1 | 0.90 | 0.85 | 0.815 | 0.795 | 0.784 |
第二次试验 | x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
(4)根据上述实验结果,该反应的平衡常数K的计算式为_________。
(5)上述反应,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)×x(I2),其中k正、k逆为速率常数,则k逆为_________(以K和k正表示)。若k正=0.002·min-1,第一次实验时,当t=20 min,v正=___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物A(分子式为C6H6O)是一种有机化工原料。A的有关转化反应如下(部分反应条件略去):
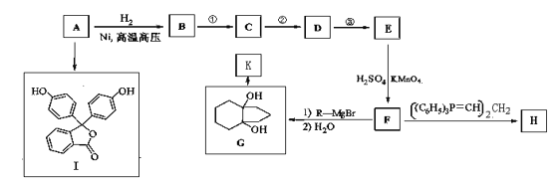
已知:①R-Br![]() R-MgBr
R-MgBr
②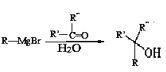
③![]() (R表示烃基或氢原子)
(R表示烃基或氢原子)
(1)写出A的结构简式:____________________________________。
(2)I是常用指示剂酚酞。写出I中含氧官能团的名称:____________和_____________。
(3)符合下列要求的G的同分异构体有________种。
a.G分子中有一个六元环 b.只有两个侧链 c.G能与NaHCO3反应放CO2气体
(4)H和K互为同分异构体。写出反应G→K的化学方程式:________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com