
科目: 来源: 题型:
【题目】铬是常见的过渡金属之一,研究铬的性质具有重要意义。

(1)在右图装置中,观察到装置甲铜电极上产生大量的无色气体; 而装置乙中铜电极上无气体产生,铬电极上产生大量红棕色气体。由此可得到的结论是__________________。
(2)工业上使用下图装置,采用石墨作电极电解Na2CrO4溶液,使Na2CrO4转化为Na2Cr2O7,其转化原理为_____________________________________。

(3)CrO3和K2Cr2O7均易溶于水,它们是工业废水造成铬污染的主要原因。要将Cr(Ⅵ)转化为Cr (Ⅲ) 常见的处理方法是电解法和铁氧磁体法。
①电解法: 将含Cr2O72- 的废水通入电解槽内,用铁作阳极,在酸性环境中,加入适量的NaCl 进行电解,使阳极生成的Fe2+和Cr2O72- 发生反应,其离子方程式为_______________。阴极上Cr2O72- 、H+、Fe3+都可能放电。若Cr2O72- 放电,则阴极的电极反应式为_________; 若H+放电,则阴极区形成Fe(OH)3和Cr(OH)3沉淀,已知:Cr3+![]() Cr(OH)3
Cr(OH)3![]() CrO2-,则阴极区溶液pH 的范围为_________。
CrO2-,则阴极区溶液pH 的范围为_________。
②铁氧磁体法: 在含Cr (Ⅵ) 的废水中加入绿矾,在pH<4时发生反应使Cr (Ⅵ) 转化为Cr (Ⅲ),调节溶液pH 为6~8,使溶液中的Fe (Ⅱ)、F e(Ⅲ)、Cr (Ⅲ)析出组成相当于Fe(Ⅱ) [Fe(Ⅲ)x·Cr (Ⅲ)2-x] O4(铁氧磁体) 的沉淀,则铁氧磁体中x=_________; 若废水中Cr (Ⅵ) 以CrO3计,用该法除去废水中的Cr (Ⅵ),加入的FeSO4·7H2O 与CrO3的质量比为_________。
查看答案和解析>>
科目: 来源: 题型:
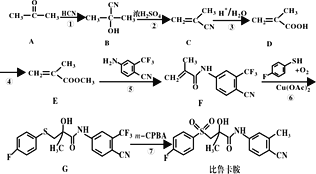
【题目】比鲁卡胺(分子结构见合成线路)是有抗癌活性,其一种合成路线如图:
回答下列问题
(1)A的化学名称为__。
(2)D中官能团的名称是__。
(3)反应④所需试剂、条件分别为__、__。
(4)写出⑤的反应方程式__。
(5)F的分子式为__。
(6)写出与E互为同分异构体,且符合下列条件的化合物的结构简式__。
①所含官能团类别与E相同;②核磁共振氢谱为三组峰,峰面积比为1:1:6
(7)参考比鲁卡胺合成的相关信息,完成如图合成线路(其他试剂任选)___。

查看答案和解析>>
科目: 来源: 题型:
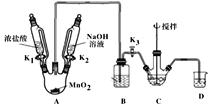
【题目】铋酸钠(NaBiO3)是分析化学中的重要试剂,在水中缓慢分解,遇沸水或酸则迅速分解。某兴趣小组设计实验制取铋酸钠并探究其应用。回答下列问题:
Ⅰ.制取铋酸钠
制取装置如图(加热和夹持仪器已略去),部分物质性质如下:
物质 | NaBiO3 | Bi(OH)3 |
性质 | 不溶于冷水,浅黄色 | 难溶于水;白色 |
(1)B装置用于除去HCl,盛放的试剂是___;
(2)C中盛放Bi(OH)3与NaOH混合物,与Cl2反应生成NaBiO3,反应的离子方程式为___;
(3)当观察到___(填现象)时,可以初步判断C中反应已经完成;
(4)拆除装置前必须先除去烧瓶中残留Cl2以免污染空气。除去Cl2的操作是___;
(5)反应结束后,为从装置C中获得尽可能多的产品,需要的操作有___;
Ⅱ.铋酸钠的应用——检验Mn2+
(6)往待测液中加入铋酸钠晶体,加硫酸酸化,溶液变为紫红色,证明待测液中存在Mn2+。
①产生紫红色现象的离子方程式为___;
②某同学在较浓的MnSO4溶液中加入铋酸钠晶体,加硫酸酸化,结果没有紫红色出现,但观察到黑色固体(MnO2)生成。产生此现象的离子反应方程式为___。
Ⅲ.产品纯度的测定
(7)取上述NaBiO3产品wg,加入足量稀硫酸和MnSO4稀溶液使其完全反应,再用cmo1·L-1的H2C2O4标准溶液滴定生成的MnO4-(已知:H2C2O4+MnO4-——CO2+Mn2++H2O,未配平),当溶液紫红色恰好褪去时,消耗vmL标准溶液。
该产品的纯度为___(用含w、c、v的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,二氧化碳可合成低碳烯烃,缓解温室效应、充分利用碳资源。
(1)已知:①C2H4(g)+2O2(g)=2CO2(g)+2H2(g) ΔH1
②2H2(g)+O2(g)=2H2O(1) ΔH2
③H2O(1)=H2O(g) ΔH3
④2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH4
C2H4(g)+4H2O(g) ΔH4
则ΔH4=___(用ΔH1、ΔH2、ΔH3表示)。
(2)反应④的反应温度、投料比[![]() =x]对CO2平衡转化率的影响如图所示。
=x]对CO2平衡转化率的影响如图所示。
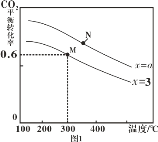
①a__3(填“>”、“<”或“=”);M、N两点反应的平衡常数KM__KN(填填“>”、“<”或“=”)
②M点乙烯体积分数为__;(保留2位有效数字)
③300℃,往6L反应容器中加入3molH2、1molCO2,反应10min达到平衡。求0到10min氢气的平均反应速率为__;
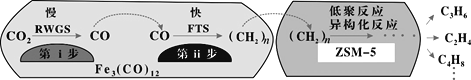
(3)中科院兰州化学物理研究所用Fe3(CO)12/ZSM-5催化CO2加氢合成低碳烯烃反应,所得产物含CH4、C3H6、C4H8等副产物,反应过程如图。
催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表。
助剂 | CO2转化率 (%) | 各产物在所有产物中的占比(%) | ||
C2H4 | C3H6 | 其他 | ||
Na | 42.5 | 35.9 | 39.6 | 24.5 |
K | 27.2 | 75.6 | 22.8 | 1.6 |
Cu | 9.8 | 80.7 | 12.5 | 6.8 |
①欲提高单位时间内乙烯的产量,在Fe3(CO)12/ZSM-5中添加__助剂效果最好;加入助剂能提高单位时间内乙烯产量的根本原因是__;
②下列说法正确的是__;
a.第ⅰ步所反应为:CO2+H2![]() CO+H2O
CO+H2O
b.第ⅰ步反应的活化能低于第ⅱ步
c.催化剂助剂主要在低聚反应、异构化反应环节起作用
d.Fe3(CO)12/ZSM-5使CO2加氢合成低碳烯烃的ΔH减小
e.添加不同助剂后,反应的平衡常数各不相同
(4)2018年,强碱性电催化还原CO2制乙烯研究取得突破进展,原理如图所示。
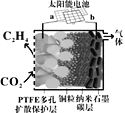
①b极接的是太阳能电池的__极;
②已知PTFE浸泡了饱和KCl溶液,请写出阴极的电极反应式__。
查看答案和解析>>
科目: 来源: 题型:
【题目】烟气(主要污染物SO2、NOX)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中的SO2、NOx 的含量。
(1) O3氧化烟气中SO2、NOx 的主要反应的热化学方程式为: NO(g)+O3(g)![]() NO2(g)+ O2(g) ΔH=-200.9 kJ·mol-13NO(g)+O3(g)
NO2(g)+ O2(g) ΔH=-200.9 kJ·mol-13NO(g)+O3(g)![]() 3NO2(g) ΔH=-317.3kJ·mol-1。则2NO2(g)
3NO2(g) ΔH=-317.3kJ·mol-1。则2NO2(g)![]() 2NO(g)+O2(g)的ΔH=_____________kJ·mol-1
2NO(g)+O2(g)的ΔH=_____________kJ·mol-1
(2)T℃时,利用测压法在刚性反应器中,投入一定量的NO2发生反应3NO2(g)![]() 3NO(g)+O3(g),体系的总压强 p随时间 t的变化如下表所示:
3NO(g)+O3(g),体系的总压强 p随时间 t的变化如下表所示:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
压强/MPa | 20.00 | 21.38 | 22.30 | 23.00 | 23.58 | 24.00 | 24.00 |
①若降低反应温度,则平衡后体系压强 p______24.00 MPa(填“>”、“<”或“=”),原因是____________。
②15min 时,反应物的转化率 α=______。
③T℃时反应3NO2(g)![]() 3NO(g)+O3(g)的平衡常数Kp=____________(Kp 为以分压表示的平衡常数,分压等于总压乘以该气体的物质的量分数)
3NO(g)+O3(g)的平衡常数Kp=____________(Kp 为以分压表示的平衡常数,分压等于总压乘以该气体的物质的量分数)
(3)T℃时,在体积为2L的密闭刚性容器中,投入2 mol NO2发生反应2NO2(g)![]() 2NO(g)+O2(g),实验测得:v正=k正 c2(NO2),v逆=k逆 c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。在温度为T℃时NO2的转化率随时间变化的结果如图所示(反应在5.5min时达到平衡):
2NO(g)+O2(g),实验测得:v正=k正 c2(NO2),v逆=k逆 c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。在温度为T℃时NO2的转化率随时间变化的结果如图所示(反应在5.5min时达到平衡):

①在体积不变的刚性容器中,投入固定量的NO2发生反应,要提高NO2转化率,可采取的措施是______________、___________。
②由图中数据,求出该反应的平衡常数为_________。
③计算A 点处v正/v逆=_________________________(保留1位小数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】快离子导体是一类具有优良离子导电能力的固体电解质。图1(Li3SBF4)和图2是潜在的快离子导体材料的结构示意图。回答下列问题:
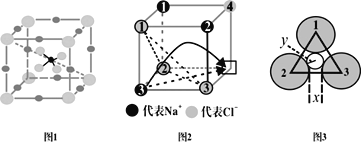
(1)S+2e-=S2-过程中,获得的电子填入基态S原子的___(填轨道符号);
(2)BF3+NH3=NH3BF3的反应过程中,形成化学键时提供电子的原子轨道符号是___;产物分子中采取sp3杂化轨道形成化学键的原子是___;
(3)基态Li+、B+分别失去一个电子时,需吸收更多能量的是___,理由是___;
(4)图1所示的晶体中,锂原子处于立方体的位置___;若其晶胞参数为apm,则晶胞密度为___g·cm-3(列出计算式即可)
(5)当图2中方格内填入Na+时,恰好构成氯化钠晶胞的![]() ,且氯化钠晶胞参数a=564pm。氯化钠晶体中,Cl-按照A1密堆方式形成空隙,Na+填充在上述空隙中。每一个空隙由___个Cl-构成,空隙的空间形状为___;
,且氯化钠晶胞参数a=564pm。氯化钠晶体中,Cl-按照A1密堆方式形成空隙,Na+填充在上述空隙中。每一个空隙由___个Cl-构成,空隙的空间形状为___;
(6)温度升高时,NaCl晶体出现缺陷(如图2所示,某一个顶点没有Na+,出现空位),晶体的导电性大大增强。该晶体导电时,在电场作用下迁移到空位上,形成电流。迁移的途径有两条(如图2中箭头所示):
途径1:在平面内挤过2、3号氯离子之间的狭缝(距离为x)迁移到空位。
途径2:挤过由1、2、3号氯离子形成的三角形通道(如图3,小圆的半径为y)迁移到空位。已知:r(Na+)=95pm,r(Cl-)=185pm,![]() =1.4,
=1.4,![]() 。
。
①x=___,y=___;(保留一位小数)
②迁移可能性更大的途径是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】肼是一种高能燃料。已知各共价键键能(断裂或形成1mol共价键时吸收或释放的能量)如表:
N≡N | O=O | N-N | N-H | O-H | |
键能(KJmol﹣1) | 946 | 497 | 154 | 391 | 463 |
(1)N2H4(g)+O2(g)N2(g)+2H2O(l) H=________KJmol﹣1 。
(2)密闭容器中进行反应:3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g) H<0反应的化学平衡表达式为K=________。
Fe3O4(s)+4H2(g) H<0反应的化学平衡表达式为K=________。
(3)已知:600℃时,上述反应的平衡常数K=16。现有如图甲(恒温恒压)和如图乙(恒温恒容)两容器:
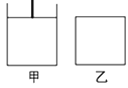
起始时按下表所示分别加入各物质,体积为2L,在600℃时反应经过一段时间后均达平衡。
Fe | H2O(g) | Fe3O4 | H2 | |
甲/mol | 2.0 | 1.0 | 2.0 | 0.5 |
乙/mol | 2.0 | 2.0 | 2.0 | 1.0 |
①关于甲、乙容器,下列法正确的是________。
A.反应开始时两容器内的逆反应速率:甲<乙
B.若甲容器内气体的密度不再变化,则说明反应已达到平衡状态
C.若乙容器内气体的压强不再变化,则说明反应已达到平衡状态
D.平衡后添加Fe3O4,两容器内的平衡均逆向移动
②投料后甲5min达平衡,则此段时间内的平均反应速率v(H2)=________。
③平衡后若将乙容器体系温度突然降低100℃,图象中能正确反映平衡移动过程中容器内变化情况的是________。
A.  B.
B.  C.
C. 
(4)如图为恒容绝热容器:

进行上述反应,起始与平衡时的各物质的量见表:
Fe | H2O(g) | Fe3O4 | H2 | |
起始/mol | 3.0 | 3.0 | 0 | 0 |
平衡/mol | m | n | p | q |
Fe | H2O(g) | Fe3O4 | H2 | |
A/mol | 3.0 | 3.0 | 0 | 0 |
B/mol | 0 | 0 | 3.0 | 3.0 |
C/mol | m | n | p | q |
若在达到平衡后的容器丙中,分别按照下列A、B、C三种情况继续添加各物质,则再次达平衡时,容器丙中H2的百分含量按由大到小的顺序______(用A、B、C表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向盛50mL0.100mol·L-1盐酸的两个烧杯中各自匀速滴加50mL的蒸馏水、0.100mol·L-1醋酸铵溶液,测得溶液pH随时间变化如图所示。已知Ka(CH3COOH)=1.8×10-5,Kb(NH3·H2O)=1.8×10-5。下列说法正确的是( )
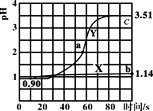
A.曲线X是盐酸滴加蒸馏水的pH变化图,滴加过程中溶液各种离子浓度逐渐减小
B.曲线Y上的任意一点溶液中均存在c(CH3COO-)<c(NH4+)
C.a点溶液中n(Cl-)+n(CH3COO-)+n(OH)-n(NH4+)=0.01mol
D.b点溶液中水电离的c(H+)是c点的102.37倍
查看答案和解析>>
科目: 来源: 题型:
【题目】高能LiFePO4电池多应用于公共交通,结构如图所示。电池中间是聚合物的隔膜,其主要作用是在反应过程中只让Li+通过,原理如下:(1x)LiFePO4+xFePO4+LixCn![]() LiFePO4+nC。下列说法错误的是( )
LiFePO4+nC。下列说法错误的是( )

A.放电时,Li+向正极移动
B.放电时,电子由负极→用电器→正极
C.充电时,阴极反应为xLi++nC+xe-=LixCn
D.充电时,阳极质量增重
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为某漂白剂的结构。已知:W、Y、Z是不同周期、不同主族的短周期元素,W、Y、Z原子最外层电子数之和等于X原子最外层电子数,W、X对应的简单离子核外电子排布相同。下列叙述错误的是( )
![]()
A.W、X对应的简单离子的半径:X>W
B.电解W的氯化物水溶液可以制得W单质
C.实验室可用X和Z形成的某种化合物制取单质X
D.25℃时,Y的最高价氧化物对应水化物的钠盐溶液pH大于7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com