
科目: 来源: 题型:
【题目】煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料的过程。水煤气生产原理为:C(s)+H2O(g)![]() CO(g)+H2(g)-131.3kJ。
CO(g)+H2(g)-131.3kJ。
(1)该反应的平衡常数K的表达式__;温度升高,K值__(填“变大”、“不变”或“变小”)。
(2)一定温度下,在一个容积不变的密闭容器中进行水煤气的生产反应,下列能判断该反应达到化学平衡状态的是__。
A.容器内压强不变 B.容器内气体密度不变
C.v(CO)=v(H2O) D.c(CO)=c(H2)
(3)如反应的容器容积为1.0L,反应时间为5.0min,容器内气体密度增大了0.12g/L,在这段时间内CO的平均反应速率为__。
(4)研究表明:在使用等质量催化剂时,增大催化剂的表面积可提高化学反应速率,为了分别验证温度,催化剂的表面积对化学反应速率的影响规律,至少应该设计__个实验。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,下列各组离子在指定溶液能大量共存的是
A.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+
B.由水电离的c(H+)=1×10-14mol·L-1的溶液中:Ca2+、K+、Cl-、HCO3-
C.![]() =1012的溶液中:NH4+、Al3+、NO3-、Cl-
=1012的溶液中:NH4+、Al3+、NO3-、Cl-
D.c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO42-、SCN-
查看答案和解析>>
科目: 来源: 题型:
【题目】烷烃C5H12有三种同分异构体,有关它们的结构和性质的说法不正确的是( )
A.三种同分异构体在常温常压下均为液体
B.其中一种同分异构体的碳原子间结构:具有空间正四面体对称结构
C.三种同分异构体具有相同的分子式.相对原子质量,化学性质相似
D.C5H11Cl共有8种同分异构体
查看答案和解析>>
科目: 来源: 题型:
【题目】Na2CO3溶液中存在水解平衡:CO32-+H2O![]() HCO3-+OH-。下列说法错误的是( )
HCO3-+OH-。下列说法错误的是( )
A.加水稀释,溶液中所有离子的浓度都减小B.通入CO2,溶液pH减小
C.加入NaOH固体,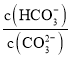 减小D.升高温度,平衡常数增大
减小D.升高温度,平衡常数增大
查看答案和解析>>
科目: 来源: 题型:
【题目】如图表示元素周期表中1~14周期的一部分,关于元素X、Y、Z、W的叙述错误的是( )
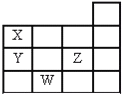
A.X、Y的最高价氧化物的水化物酸性为Y<X
B.Y、Z的气态氢化物的稳定性为Y<Z
C.Z有5种不同运动状态的电子
D.W的原子序数比Y大19
查看答案和解析>>
科目: 来源: 题型:
【题目】异丁烷、乙醇硫酸氢钾、液氮均可做制冷剂,下列关于它们的相关表示正确的是( )
A.异丁烷的结构简式为:(CH3)3CH
B.乙醇的比例模型为:![]()
C.熔融KHSO4的电离方程式:KHSO4→K++H++SO42-
D.氮原子核外电子的轨道表示式:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关物质检验的实验结论正确的是( )
实验操作 | 现象 | 结论 | |
A | 某溶液中加入氯化钡溶液 | 生成白色沉淀 | 该溶液一定含有SO42- |
B | 某溶液中加入无色酚酞试液 | 溶液变红色 | 该溶液一定是碱溶液 |
C | 将某溶液做焰色反应 | 焰色呈黄色 | 该溶液一定含有Na+ |
D | 往某溶液中加入盐酸 | 产生无色气体 | 该溶液一定含有CO32- |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】锂离子电池能够实现千余次充放电,但长时间使用后电池会失效,其中的化学试剂排放至环境中不仅会造成环境污染,还会造成资源的浪费。实验室模拟回收锂离子电池中的Co、Ni、Li的流程如图。
已知:LiCoO2难溶于水,易溶于酸。回答下列问题:
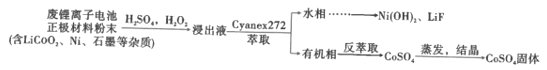
(1)LiCoO2中Co的化合价是__。
(2)LiCoO2在浸出过程中反应的离子方程式是__。
(3)浸出剂除了H2O2外,也可以选择Na2S2O3,比较二者的还原效率H2O2__(填“>”或“<”)Na2S2O3(还原效率:还原等物质的量的氧化剂消耗还原剂的物质的量)。
(4)提高浸出效率的方法有__。
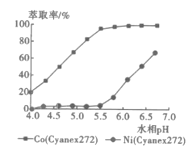
(5)利用Cyanex272萃取时,pH对钴、镍萃取分离效果的影响如图。从图中数据可知,用Cyanex272萃取分离时,最佳pH是__。
(6)反萃取的离子方程式为2H++CoR2=Co2++2HR,则反萃取剂的最佳选择是__。
(7)常温下,若水相中的Ni2+的质量浓度为1.18g·L-1,则pH=__时,Ni2+开始沉淀。[Ksp(Ni(OH)2=2×10-15]
(8)参照题中流程图的表达,结合信息设计完成从水相中分离Ni和Li的实验流程图(如图)___。
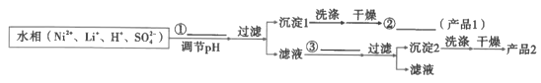
已知:
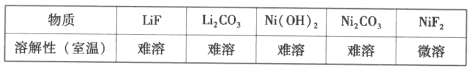
提供的无机试剂:NaOH、Na2CO3、NaF。
查看答案和解析>>
科目: 来源: 题型:
【题目】新型超高能材料是国家核心军事力量制高点的重要标志,高性能炸药BNCP的结构如图,回答下列问题:
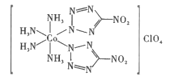
(1)BNCP中Co3+的基态价层电子轨道表示式是__,Co3+的配位数是__,阴离子ClO4-的中心原子杂化类型是__。
(2)1mol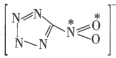 配体中的σ键的数目是__,已知该配体是平面结构,图中标记的N原子与O原子之间的σ键是由N原子的__杂化轨道与O原子的__轨道重叠形成的。
配体中的σ键的数目是__,已知该配体是平面结构,图中标记的N原子与O原子之间的σ键是由N原子的__杂化轨道与O原子的__轨道重叠形成的。
(3)比较NO2+、NO2、NO2-的键角大小:__,与NO2-互为等电子体的单质是___。
(4)比较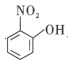 、
、![]() 的沸点并说明理由:__。
的沸点并说明理由:__。
(5)比较H2O与OF2的极性大小并说明理由:__。
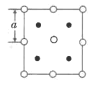
(6)2018年南京理工大学胡炳成团队合成全国首个全氮阴离子,全氮阴离子的盐AgN5的晶体结构中:N5-采取面心立方最密堆积,Ag+填在正四面体空隙中,从晶胞上方的俯视投影图如图。每个晶胞中含有的N5-的数目是__。Ag+与N5-最近的距离是__(用a表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】以菱镁矿(主要成分是碳酸镁,含少量FeCO3和不溶性杂质)为原料制取硫酸镁晶体(MgSO4·7H2O)的流程如图:
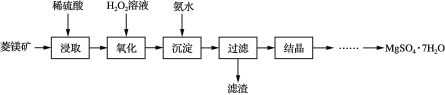
(1)“浸取”时通常将菱镁矿石进行粉碎,其目的是___。
(2)写出碳酸镁与稀硫酸反应的化学方程式___。
(3)“氧化”和“沉淀”是将“浸取”过程中产生的Fe2+转化为Fe(OH)3沉淀,则“过滤”所得滤液中含有的阳离子主要有___和___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com