
科目: 来源: 题型:
【题目】化学在科技进步方面发挥着重要的作用。下列说法正确的是
A. 是制备有机发光二极管OLED的材料之一,其属于有机高分子化合物
是制备有机发光二极管OLED的材料之一,其属于有机高分子化合物
B.2019世界能源大会把核能作为含碳能源重要替代品,核电站把化学能转化为电能
C.DAC法能够实现直接从空气中捕获二氧化碳,该法可缓解全球日益严重的温室效应
D.以纯净物聚丙烯为原料生产的熔喷布口罩,在“新冠肺炎战疫”中发挥了重要作用
查看答案和解析>>
科目: 来源: 题型:
【题目】根据碘与氢气反应的热化学方程式:
①I2(g)+H2(g) ![]() 2HI(g) △H=-9.48 k.J·mol-1
2HI(g) △H=-9.48 k.J·mol-1
②I2(s)+H2((g) ![]() 2HI(g)△H=+26.48k.J·mol-1
2HI(g)△H=+26.48k.J·mol-1
下列判断正确的是
A.254gI(g)中通入2gH2(g),反应放热9.48kJ
B.1mol固态碘与1mol气态碘所含的能量相差17.00kJ
C.反应②的反应物总能量比反应①的反应物总能量低
D.反应①的生成物比反应②的生成物稳定
查看答案和解析>>
科目: 来源: 题型:
【题目】某三元羧酸 H3A 在表面活性剂、洗涤剂、润滑剂等方面具有重要的地位。常温时,向 10 mL 0.01 mol·L1 的 H3A 溶液中滴入 0.01 mol·L1 的 NaOH 溶液,H3A、H2A、HA2、A3的物质的量分数与溶液的 pH 的关系如 图所示。下列说法错误的是( )
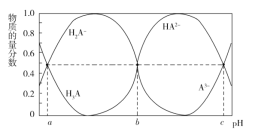
A.该温度下,H3A 的电离常数 Ka1=10a
B.若 b=7,加入 20 mL NaOH 溶液时,溶液的 pH<7
C.NaOH 溶液的体积为 30 mL 时,溶液中:c(OH)=3c(H3A)+2c(H2A)+c(HA2)+c(H+)
D.反应 2H2A![]() H3A+HA2在该温度下的平衡常数K=10a-b
H3A+HA2在该温度下的平衡常数K=10a-b
查看答案和解析>>
科目: 来源: 题型:
【题目】W、X、Y、Z为短周期原子序数依次增大的主族元素,其原子序数之和为30,W与X、Y、Z都能形成共价化合物,Y、W形成的常见化合物溶于水显碱性,Z、W形成的化合物溶于水显酸性,四种元素形成的某种化合物的结构式为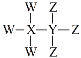 。下列说法错误的是
。下列说法错误的是
A.X为硼元素或碳元素
B.Y不属于第ⅣA族元素
C.W与Y、Z分别形成的常见化合物能反应生成盐
D.最高价氧化物对应的水化物的酸性:Z>Y
查看答案和解析>>
科目: 来源: 题型:
【题目】除了酸以外,某些盐也能溶解沉淀。利用如表三种试剂进行实验,相关分析不正确的是
编号 | ① | ② | ③ |
分散质 | Mg(OH)2 | HCl | NH4Cl |
备注 | 悬浊液 | 1mol/L | 1mol/L |
A.向①中加入②,c(OH-)减小,Mg(OH)2溶解平衡正向移动
B.向①中加入酚酞显红色说明物质的“不溶性”是相对的
C.向①中加入③沉淀溶解,说明Mg(OH)2比NH3·H2O更难电离
D.①、③混合后发生反应:Mg(OH)2(s)+2NH4+![]() Mg2++2NH3·H2O
Mg2++2NH3·H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组的同学为了验证明矾的化学组成,进行了如下实验:
(1)把明矾的水溶液分别加入两试管中,用焰色反应,透过蓝色钴玻璃观察火焰为紫色,说明含有________________;
(2)在其中一个试管中,加入过量氨水,产生大量白色沉淀,将沉淀分为两部分,分别加入过量的盐酸和氢氧化钠,沉淀均消夫,说明明矾溶液中含____________(离子符号),写出白色沉淀和氢氧化钠溶液反应的离子方程式________________________________________________;
(3)在另一个试管中,加入盐酸酸化过的氯化钡溶液,产生白色沉淀,说明明矾溶液中含____________________________ (离子符号);
(4)明矾水溶液的pH值________7,其原因是________________________________ (离子方程式);明矾可以用作净水剂,其原因是____________________________________,
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年诺贝尔化学奖颁给在锂离子电池发展方面作出突出贡献的三位科学家,颁奖词中说:他们创造了一个可再充电的世界。下面是最近研发的Ca-LiFePO4可充电电池的工作示意图,锂离子导体膜只允许Li+通过,电池反应为:xCa2++2LiFePO4![]() xCa+2Li1-xFePO4+2xLi+。下列说法错误的是
xCa+2Li1-xFePO4+2xLi+。下列说法错误的是

A.LiPF6-LiAsF6为非水电解质,其与Li2SO4溶液的主要作用都是传递离子
B.放电时,负极反应为:LiFePO4xe===Li1-xFePO4+xLi+
C.充电时,Li1-xFePO4/LiFePO4电极发生Li+脱嵌,放电时发生Li+嵌入
D.充电时,当转移0.2 mol电子时,左室中电解质的质量减轻2.6 g
查看答案和解析>>
科目: 来源: 题型:
【题目】镁铝合金10.2g溶于50mL4 mol/L的盐酸溶液中,若加入2mol/LNaOH溶液,使得溶液中的沉淀达到最大值,则需要加入氢氧化钠溶液的体积为
A.0.2LB.0.5LC.0.8LD.0.1L
查看答案和解析>>
科目: 来源: 题型:
【题目】在 Al2(SO4)3和 MgSO4的混合溶液中,滴加 NaOH溶液,生成沉淀的量与滴入 NaOH 溶液的体积关系如图所示,则原混合液中Al2(SO4)3与 MgSO4的物质的量浓度之比为

A.1:1
B.1:2
C.2:1
D.3:1
查看答案和解析>>
科目: 来源: 题型:
【题目】(14分)工业上常用苏打烧结法提取自然界中的稀散元素硒(Se),我国科研人员自主设计的利用粗铜电解精炼所产生含硒化亚铜(Cu2Se)和碲化亚铜(Cu2Te)的阳极泥为原料,提取硒的某种工艺流程如图所示。

回答下列问题:
(1)电解精炼铜时,电源的正极连接_______(填“粗铜”或“精铜”),阳极溶解铜的质量__________(填“>”“=”或“<”)阴极析出铜的质量。
(2)“烧结”时苏打和硒化亚铜主要生成了Na2SeO3、Cu2O和CO2气体,该反应的化学方程式为________________________________。“烧结”时生成了少部分Na2SeO4,写出“还原”时反应的离子方程式____________。
(3)含硒烧结物浸取时,最佳加热方式为________________,除去的物质为___________(填化学式)。
(4)本工艺副产物TeO2用于制造红外器件、声光器件材料,可溶于强酸和强碱,并形成复盐,则TeO2属于______氧化物(填“酸性”“碱性”或“两性”)。
(5)把硫酸工业第一步的产物SO2通入Na2SeO3溶液制备硒单质,写出该反应的离子方程式_____________。若得到50 kg硒单质,至少需要___________kg质量分数为90%的FeS2矿石。(结果保留一位小数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com