
科目: 来源: 题型:
【题目】在硫酸铝、硫酸钾和明矾的混合溶液中,硫酸根离子的浓度为0.4mol·L-1,当加入等体积0.4mol·L-1氢氧化钾溶液时,生成的沉淀恰好完全溶解。则反应后溶液中钾离子的浓度约为( )
A.0.225mol·L-1B.0.25mol·L-1C.0.45mol·L-1D.0.9mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】75号元素铼Re,熔点仅次于钨,是制造航空发动机的必需元素。地壳中铼的含量极低,多伴生于钼、铜、锌、铅等矿物中。回答下列问题:
(1)锰原子价层电子的轨道表示式为__,锰处于周期表的__区。
(2)与铼伴生的铜能形成多种配合物。如:醋酸二氨合铜(I)[Cu(NH3)2]Ac可用于吸收合成氨中对催化剂有害的CO气体:[Cu(NH3)2]Ac+CO+NH3![]() [Cu(NH3)3]Ac·CO。(Ac表示醋酸根)
[Cu(NH3)3]Ac·CO。(Ac表示醋酸根)
①与铜离子形成配合物的分子或离子应具备的结构特征是__。
②醋酸根中C原子的杂化类型为__,1mol配离子[Cu(NH3)2]+中含有σ键的数目为__。
③写出与NH3互为等电子体的一种离子的化学式__。
(3)锰与铼处于同一族,金属铼的熔点高于锰,原因是___。
(4)三氧化铼为立方晶胞,晶胞参数为apm,三氧化铼的摩尔质量为Mg/mol;铼原子占据顶点,氧原子占据所有棱心。则铼原子的配位数为__,铼原子填在了氧原子围成的空隙中___(填“四面体”“立方体”或“八面体”),三氧化铼的密度为__g/cm3。(用NA表示阿伏加德罗常数的值)
查看答案和解析>>
科目: 来源: 题型:
【题目】环境治理依然是当今的热点问题。研究相关问题具有重要意义。回答下列问题:
(1)2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
①2NO(g)![]() N2O2(g) 快 ΔH1<0
N2O2(g) 快 ΔH1<0
②N2O2(g)+O2(g)![]() 2NO2(g) 慢 ΔH2<0
2NO2(g) 慢 ΔH2<0
反应2NO(g)+O2(g)![]() 2NO2(g)的H=__(用含H1和H2的式子表示)。反应①的活化能E1与反应②的活化能E2的大小关系为E1__E2(填“>”、“<”或“=”)。
2NO2(g)的H=__(用含H1和H2的式子表示)。反应①的活化能E1与反应②的活化能E2的大小关系为E1__E2(填“>”、“<”或“=”)。
(2)工业上常利用CH4来吸收CO2生成CO和H2,再用H2和CO合成甲醇。如在恒容密闭容器中通入物质的量浓度均为1.0mol·L-1的CH4与CO2,在一定条件下仅发生反应:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图1所示:
2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图1所示:
则:①该反应的ΔH___(填“<”“=”或“>”)0。
②压强p1、p2、p3、p4由大到小的关系为___。判断的理由是______。压强为p4时,在b点:v(正)___(填“<”“=”或“>”)v(逆)。
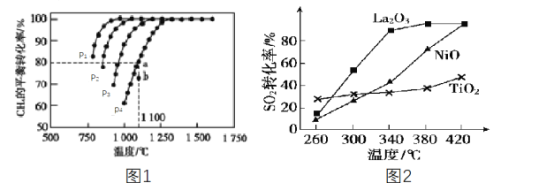
③对于气相反应,用某组分(B)的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数(记作Kp),当p4=0.36MPa,则a点的平衡常数Kp=___(保留3位有效数字,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)燃煤烟气中硫的回收反应为2CO(g)+SO2(g)=2CO2(g)+S(l)。在其他条件相同、催化剂不同时,硫的回收反应中SO2的转化率随反应温度的变化如图2所示。260℃时,____ (填“La2O3”NiO”或“TiO2”)的催化效率最高。La2O3和NiO作催化剂均可能使SO2的转化率达到很高,不考虑价格因素,选择La2O3的主要优点是__。
(4)该小组用Na2SO3溶液充分吸收SO2得到NaHSO3溶液,然后电解该溶液制得了硫酸。原理如图3,写出开始电解时阳极的电极反应式__。

查看答案和解析>>
科目: 来源: 题型:
【题目】羟胺的电离方程式为:NH2OH+H2O![]() NH3OH++OH-(25℃时,Kb=9.0×10-9)。用0.lmol/L盐酸滴定20mL0.lmol/L胺溶液,恒定25℃时,滴定过程中由水电离出来的H+浓度的负对数与盐酸体积的关系如图所示(己知:lg3=0.5)。下列说法错误的是( )
NH3OH++OH-(25℃时,Kb=9.0×10-9)。用0.lmol/L盐酸滴定20mL0.lmol/L胺溶液,恒定25℃时,滴定过程中由水电离出来的H+浓度的负对数与盐酸体积的关系如图所示(己知:lg3=0.5)。下列说法错误的是( )
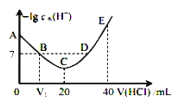
A.图中V1<10
B.A点对应溶液的pH=9.5
C.A、B、C、D四点中酸性最强的点为C点
D.E点对应溶液中存在:c(H+)=c(OH-)+c(NH3OH+)+2c(NH2OH)
查看答案和解析>>
科目: 来源: 题型:
【题目】我国科学家在天然气脱硫研究方面取得了新进展,其原理如图所示。下列有关说法错误的是( )
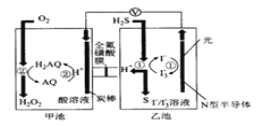
A.图中导线上标记方向为电子流向
B.装置中H+向甲池迁移
C.正极上的电极反应式为O2+4H++4e-=2H2O
D.乙池溶液中发生反应的离子方程式:H2S+I3- =3I-+S↓+2H+
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期主族元素X、Z、Y、P的原子序数逐渐增大。四种元素形成的化合物结构如图所示,其中各原子的核外电子排布均处于稳定结构。且X与Z、Y、P均可形成电子数相等的分子,X2P常温常压下为液体。下列说法不正确的是( )
![]()
A.X和P形成的化合物中可能存在非极性共价键
B.Z、Y、P的非金属性和最高价氧化物对应水化物的酸性都逐渐增强
C.Y的氢化物能和它的最高价氧化物对应水化物反应生成盐
D.X形成的简单离子半径不一定比Li+小
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于有机物的说法,正确的是( )
A.由甲烷在纯氧中完全燃烧只生成CO2和H2O说明甲烷不含氧元素
B.![]() 最多有16个原子共平面
最多有16个原子共平面
C.油脂在人体内水解为氨基酸和甘油等小分子才能被吸收
D.甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
查看答案和解析>>
科目: 来源: 题型:
【题目】NA代表阿伏加德罗常数的值,下列说法正确的是( )
A.0.1molH2和0.1molI2(g)于密闭容器中充分反应,容器内原子总数为0.2NA
B.常温常压下,28gFe和足量浓硝酸混合,转移电子数为1.5NA
C.标准状况下22.4LHF中含有的氟原子数目为NA
D.2gD2O和H2l8O混合物中所含中子数为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.某化工厂以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分Na2Cr2O7·2H2O),工艺流程如图:
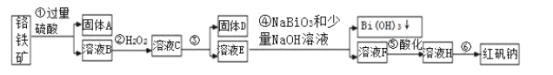
i.常温,NaBiO3不溶于水,有强氧化性,碱性条件下,能将Cr3+转化为CrO42-。
ii.常温时,部分金属离子开始沉淀和完全沉淀时的pH值
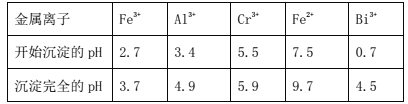
(1)步骤①提高酸溶速率的措施__(任填一条即可)。固体A的成分是___。
(2)步骤③需加氢氧化钠溶液调节pH,调节pH范围为__,目的是__。
(3)写出④反应的离子方程式__。
(4)将溶液H经过__即得红矾钠粗晶体。
Ⅱ.经该工厂的工业废水中含1.00×10-3mol·L-1的Cr2O72-,其毒性较大。该化工厂的科研人员为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Fe的化合价依次为+3、+2),又设计了如下工艺流程:
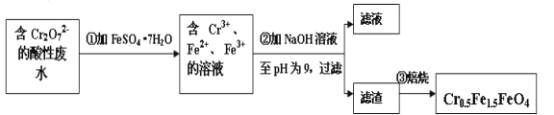
(5)第①步反应的离子方程式是__。
(6)常温时,如忽略步骤①所加FeSO4·7H2O所引起的溶液体积变化,依据上表数据,则步骤②加入NaOH溶液调节溶液的pH至9时,溶液中Cr3+的浓度为___mol/L(101/2≈3.2)。
(7)欲使1L该废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4。理论上需要加入FeSO4·7H2O的质量为__g(已知FeSO4·7H2O的摩尔质量为278g/mol)。
查看答案和解析>>
科目: 来源: 题型:
【题目】阿克他利M(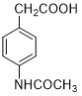 )是一种抗风湿性关节炎药物,其合成路线如下:
)是一种抗风湿性关节炎药物,其合成路线如下:

(1)反应1的类型为______________________________。
(2)反应2的试剂为______________________________。
(3)写出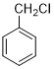 的所有含苯环结构的同分异构体的结构简式______________。
的所有含苯环结构的同分异构体的结构简式______________。
(4)写出由对硝基苯乙酸(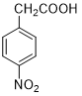 )得到对硝基苯乙酸乙酯的试剂和条件______。
)得到对硝基苯乙酸乙酯的试剂和条件______。
(5)A的分子式为C7H8,写出由A合成苯甲醛的合成路线。
(合成路线常用的表示方式为: )
)
_________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com