
科目: 来源: 题型:
【题目】实验室用酸性蚀刻废液(含![]() 等)和碱性蚀刻废液[NH4+、Cu(NH3)42+ 、NH3·H2O等]制备CuI(白色固体)的实验流程如下:
等)和碱性蚀刻废液[NH4+、Cu(NH3)42+ 、NH3·H2O等]制备CuI(白色固体)的实验流程如下:
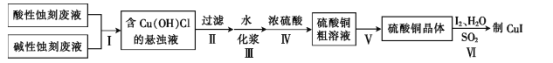
(1)步骤Ⅰ中发生了多个反应,其中![]() 与盐酸反应生成Cu(OH)Cl的离子方程式为____。
与盐酸反应生成Cu(OH)Cl的离子方程式为____。
(2)步骤Ⅳ需控制pH为1~2,80 ℃下进行,合适的加热方式是____。
(3)步骤Ⅴ的具体步骤是蒸发浓缩、______、____。
(4)步骤Ⅵ在下列装置(夹持及加热装置已省略)中进行。
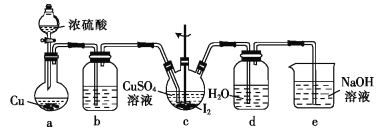
①装置a中盛装浓硫酸的仪器的名称是___,圆底烧瓶中发生反应的化学方程式为___。
②装置c中反应完成的现象是_____。
③用装置d中的溶液洗涤制得的CuI的目的是____,然后再用无水乙醇洗涤的目的是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】用系统命名法命名或写出结构简式:
(1)3-甲基-2-丙基-1-戊烯的结构简式为______________________________
(2)![]() 名称为_______________________________________
名称为_______________________________________
(3)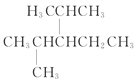 名称为:________________________________
名称为:________________________________
(4)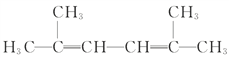 名称为:_______________
名称为:_______________
(5)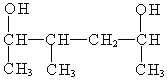 名称为:___________________________
名称为:___________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】以乙炔为主要原料可以合成聚氯乙烯、聚丙烯腈和氯丁橡胶,有关合成路线图如下:
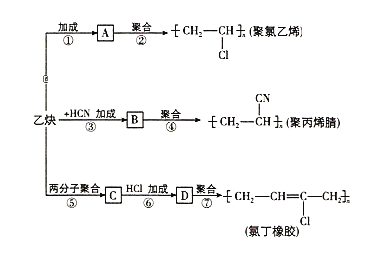
已知反应:nCH2=CH-CH=CH2![]()
![]()
请完成下列各题:
(1)写出物质的结构简式:A__________,C__________。
(2)写出反应的化学方程式:
反应① :____________________;
反应③ :____________________;
反应⑦ :____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】“奥司他韦”是化学家们合成的药品,能抗病毒,用于治疗流感。于2001年在我国投入使用。其合成路线如下

已知: +H2O
+H2O
(1)莽草酸的含氧官能团名称有:__________,反应③的反应类型:_________。
(2)反应①的反应试剂和反应条件:_____________________ 。
(3)请写出反应②的化学方程式:____________________________________ 。
(4)芳香化合物X是B的同分异构体,则符合官能团只含酚羟基的X有_____种。
(5)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。C中有_____个手性碳。
(6)设计由对甲基苯甲醛制备对醛基苯甲酸![]() 的合成路线_________________
的合成路线_________________
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物Z由如下反应得到:![]() ,Z的结构简式不可能是( )
,Z的结构简式不可能是( )
A.CH3CH2CHBrCH2BrB.CH3CH(CH2Br)2
C.CH3CHBrCHBrCH3D.CH2BrCBr(CH3)2
查看答案和解析>>
科目: 来源: 题型:
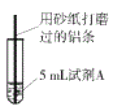
【题目】研究小组进行右图所示实验,试剂A为0.2mol/LCuSO4溶液,发现铝条表面无明显变化,于是改变实验条件,探究铝和CuSO4溶液、CuCl2溶液反应的影响因素。用不同的试剂A进行实验1~实验4,并记录实验现象:
实验序号 | 试剂A | 实验现象 |
1 | 0.2mol/LCuCl2溶液 | 铝条表面有气泡产生,并有红色固体析出 |
2 | 0.2mol/LCuSO4溶液,再加入一定质量的NaCl固体 | 开始铝条表面无明显变化,加NaCl后,铝条表面有气泡产生,并有红色固体析出 |
3 | 2mol/LCuSO4溶液 | 铝条表面有少量气泡产生,并有少量红色固体 |
4 | 2mol/LCuCl2溶液 | 反应非常剧烈,有大量气泡产生,溶液变成棕褐色,有红色固体和白色固体生成 |
(1)实验1中,铝条表面析出红色固体的反应的离子方程式为_________。
(2)实验2的目的是证明铜盐中的阴离子Cl-是导致实验1中反应迅速发生的原因,实验2中加入NaCl固体的质量为______g。
(3)实验3的目的是_________ 。
(4)经检验可知,实验4中白色固体为CuCl。甲同学认为产生白色固体的原因可能是发生了Cu+CuCl2=2CuCl的反应,他设计了右图所示实验证明该反应能够发生。
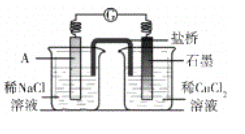
①A极的电极材料是_________。
②能证明该反应发生的实验现象是_________ 。
(5)为探究实验4中溶液呈现棕褐色的原因,分别取白色CuCl固体进行以下实验:
实验序号 | 实验操作 | 实验现象 |
i | 加入浓NaCl溶液 | 沉淀溶解,形成无色溶液 |
ii | 加入饱和AlCl3溶液 | 沉淀溶解,形成褐色溶液 |
iii | 向i所得溶液中加入2mol/LCuCl2溶液 | 溶液由无色变为褐色 |
查阅资料知:CuCl难溶于水,能溶解在Cl-浓度较大的溶液中,生成[CuCl2]
①由述球实验及资料可推断,实验4中溶液呈棕褐色的原因可能是[CuCl2]-与_____作用的结果。
②为确证实验4所得的棕褐色溶液中含有[CuCl2]-,应补充的实验是_______。
(6)上述实验说明,铝和CuSO4溶液、CuCl2溶液的反应现象与______有关。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇、乙醇来源丰富、价格低廉、运输贮存方便,都是重要的化工原料,有着重要的用途和应用前景,可以用多种方法合成。
I.用CO2生产甲醇、乙醇
(1)已知:H2的燃烧热为-285.8 kJ/mol,CH3OH(l)的燃烧热为-725.8kJ/mol,CH3OH(g)=CH3OH(l) △H= -37.3 kJ/mol,则CO2(g)+3H2(g)=CH3OH(g)+ H2O(1) △H=____kJ/mol。
(2)将CO2和H2按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应[生成 H2O(g)],如图1表示压强为0.1 MPa和5.0 MPa下CO2转化率随温度的变化关系。

①a、b两点化学反应速率分别用Va、Vb,表示,则Va ___Vb(填“大于”、“小于”或“等于”)。
②列出a点对应的平衡常数表达式K= ____________________。
(3)在1.0 L恒容密闭容器中投入1 mol CO2和2.75 mol H2发生反应:CO2(g)+3H2(g) ![]() CH3OH (g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是_____。
CH3OH (g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是_____。
A.该反应的正反应为放热反应
B.压强大小关系为p1<p2<p3
C.M点对应的平衡常数K的值约为1.04×10-2
D.在p2及512 K时,图中N点υ(正)<υ(逆)
(4)CO2催化加氢合成乙醇的反应为:2CO2(g)+6H2(g) ![]() C2H5OH(g) +3H2O(g) △H;m代表起始时的投料比,即m=
C2H5OH(g) +3H2O(g) △H;m代表起始时的投料比,即m=![]()

①图3中投料比相同,温度T3>T2>T1,则该反应的焓变△H____0(填“>”、“<”)。
②m=3时,该反应达到平衡状态后p(总)=20a MPa,恒压条件下各物质的物质的量分数与温度的关系如图4所示,则曲线b代表的物质为_________(填化学式),T4温度时,反应达到平衡时物质d的分压p(d)=___________。
Ⅱ.甲醇的应用
(5)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图5所示。

离子交换膜a为_____(填“阳膜”、“阴膜”),阳极的电极反应式为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组用图1图2所示装置进行溴乙烷性质的探究。在图1试管中加入5mL溴乙烷和10mL 6mol/L NaOH水溶液,振荡,水浴加热。将溴乙烷与NaOH乙醇溶液反应产生的气体通入图2装置。下列说法正确的是

A. 图1图2装置中分别发生的是消去反应和取代反应
B. 图1试管中物质充分反应后,可观察到液体出现分层
C. 图2中试管A的作用是除去气体中混有的溴乙烷
D. 图2若无试管A,可将B中试剂改为溴的四氯化碳溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】铁系元素是人体必需的微量元素, Fe3+可以与KSCN溶液、苯酚等发生显色作用。镁元素也是人体所必需的阳离子元素之一,它能够维持核酸结构的稳定性,调节机体免疫功能,对人体抵抗新冠病毒等病毒侵袭起着重要作用。
(1)Fe3+的基态核外电子排布式为____________________。
(2)与SCN互为等电子体且为非极性分子的化学式为__________(任写一种)。
(3)普鲁士蓝俗称铁蓝,晶胞如图甲所示(K+未画出),平均每两个晶胞立方体中含有一个K+,又知该晶体中铁元素有+2价和+3价两种,则Fe3+与Fe2+的个数比为_________。

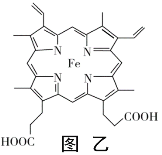
(4)血红素铁(图乙)用作铁强化剂,其吸收率比一般铁剂高3倍,在图乙中画出Fe2+与N原子间的化学键(若是配位键,需要用箭头加以表示)______________


(5)镁单质晶体中原子的堆积模型如图,它的堆积模型名称为____________;晶胞是图中的_________________(填a、b或c);配位数是__________________;紧邻的四个镁原子的中心连线构成的正四面体几何体的体积是2a cm3,镁单质的密度为ρ g·cm-3,已知阿伏伏德罗常数为NA,则镁的摩尔质量的计算式是________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组设计实验利用苯甲酸(沸点249℃)和异丙醇(沸点82℃)制备苯甲酸异丙酯(沸点218℃),实验装置如图:
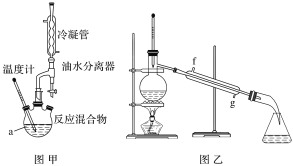
实验步骤:①在图甲干燥的仪器a中加入反应物苯甲酸、异丙醇和催化剂浓硫酸,再加入几粒沸石;②加热至70 ℃左右,保持恒温半小时;③将仪器a中反应后的液体用图乙所示装置进行精制得到产品。下列说法不正确的是
A.在仪器a中加入三种试剂的先后顺序是:浓硫酸、异丙醇、苯甲酸
B.加入的苯甲酸和异丙醇中,需过量的是苯甲酸
C.实验采用水浴加热,若温度过高会使产率减小
D.步骤③操作时应收集218 ℃的馏分,如果温度计水银球偏下,则收集的精制产品中可能混有的杂质为异丙醇
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com