
科目: 来源: 题型:
【题目】500 mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6.0 mol·L-1,用石墨做电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是( )
A. 原混合溶液中c(K+)为2 mol·L-1
B. 上述电解过程中共转移6 mol电子
C. 电解得到的Cu的物质的量为0.5 mol
D. 电解后溶液中c(H+)为2 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】高氯酸在化工生产中有广泛应用,工业上以NaClO4为原料制备高氯酸的原理如图所示.下列说法正确的是
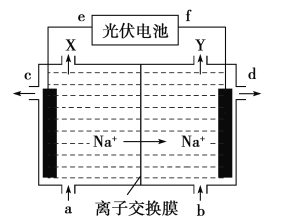
A. 上述装置中,f极为光伏电池的正极
B. 阴极的电极反应为2H2O-4e- =4H++O2↑
C. d处得到较浓的NaOH 溶液,c处得到HClO4
D. 若转移2mol电子,理论上生成100.5gHClO4
查看答案和解析>>
科目: 来源: 题型:
【题目】下列装置由甲、乙两部分组成(如图所示),甲是将废水中乙二胺[H2N(CH2)2NH2]氧化为环境友好物质形成的化学电源;乙是利用装置甲模拟工业电解法来处理含Cr2O72-废水,电解过程中溶液发生反应:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。当电池工作时,下列说法错误的是

A. 甲中H+透过质子交换膜由左向右移动
B. 乙池中Fe棒应与甲池中的M极相连
C. M极电极反应式:H2N(CH2)2NH2+4H2O-16e-=2CO2↑+N2↑+16H+
D. 若溶液中减少了0.OlmolCr2O72-,则电路中至少转移了0.06 mol电子
查看答案和解析>>
科目: 来源: 题型:
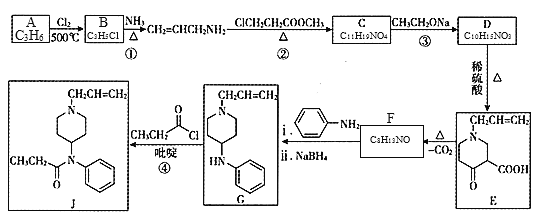
【题目】镇痛药物J的合成方法如下:
已知:
![]() +Cl-R3
+Cl-R3![]()
![]() +HCl
+HCl
R1COOR2+R3CH2COOR4![]()
![]() +R2OH
+R2OH
![]()
![]()
![]()
(R1、R2、R3、R4为氢或烃基)
(1)B的名称为______;F的结构简式为______。
(2)C中含氧官能团名称为______;②的反应类型为______反应。
(3)③的化学方程式为______。
(4)有机物K分子组成比F少两个氢原子,符合下列要求的K的同分异构体有______种。
A.遇FeCl3显紫色 B.苯环上有三个取代基
(5)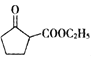 是一种重要的化工中间体。以环已醇(
是一种重要的化工中间体。以环已醇(![]() )和乙醇为起始原料,结合己知信息选择必要的无机试剂,写出
)和乙醇为起始原料,结合己知信息选择必要的无机试剂,写出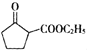 的合成路线______。(已知:RHC=CHR
的合成路线______。(已知:RHC=CHR![]() RCOOH+R′COOH,R、R′为烃基。用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)
RCOOH+R′COOH,R、R′为烃基。用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)
查看答案和解析>>
科目: 来源: 题型:
【题目】三硫代碳酸钠(Na2CS3)常用作杀菌剂、沉淀剂。某小组设计实验探究三硫代碳酸钠的性质并测定其溶液的浓度。
实验1:探究Na2CS3的性质
步骤 | 操作及现象 |
① | 取少量Na2CS3固体溶于蒸馏水配制成溶液并分成两等份 |
② | 向其中一份溶液中滴加几滴酚酞试液,溶液变红色 |
③ | 向另一份溶液中滴加酸性KMnO4溶液,紫色褪去 |
(1)H2CS3是________酸(填“强”或“弱”)。
(2)已知步骤③的氧化产物是SO42-,写出该反应的离子方程式______
(3)某同学取步骤③所得溶液于试管中,滴加足量盐酸、BaCl2溶液产生白色沉淀,他认为通过测定产生的白色沉淀的质量即可求出实验所用Na2CS3的量,你是否同意他的观点并说明理由______。
实验2:测定Na2CS3溶液的浓度

按如图所示连接好装置,取100mLNa2CS3溶液置于三颈烧瓶中,打开仪器d的活塞,滴入足量2.0mol/L稀H2SO4,关闭活塞。
已知:Na2CS3 + H2SO4=Na2SO4 + CS2 + H2S↑。CS2和H2S均有毒。CS2不溶于水,沸点46℃,与CO2某些性质相似,与NaOH作用生成Na2COS2和H2O。
(4)盛放无水CaCl2的仪器的名称是______,B中发生反应的离子方程式是______。
(5)反应结束后打开活塞k,再缓慢通入热N2一段时间,其目的是______。
(6)为了计算Na2CS3溶液的浓度,对B中混合物进行过滤、洗涤、干燥、称重,得19.2g固体,则A中Na2CS3的物质的量浓度为______。
(7)分析上述实验方案,还可以通过测定C中溶液质量的增加值来计算Na2CS3溶液的浓度,若反应结束后将通热N2改为通热空气,计算值______(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】用石墨电极完成下列电解实验
实验一 | 实验二 | |
装置 |
|
|
现象 | a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化 | 两个石墨电极附近有气泡产生;n处有气泡产生…… |
下列对实验现象的解释或推测不合理的是( )
A. a、d处:2H2O+2e-=H2↑+2OH- B. b处:2Cl--2e-=Cl2↑
C. c处发生了反应:Fe-2e-=Fe2+ D. 根据实验一的原理,实验二中m处能析出铜
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:A、B、C、D、E五种元素,原子序数依次增大。A是短周期中原子半径最大的元素,B元素3p能级半充满;C是所在周期电负性最大的元素;D是第四周期未成对电子最多的元素;E的原子序数比D大3。试回答下列有关的问题:
(1)写出D元素价电子的电子排布图:______________。
(2)D可形成化合物[D(H2O)6](NO3)3 ,[D(H2O)6](NO3)3中阴离子的立体构型是____________。NO2-中心原子的轨道杂化类型为______________,1 mol [D(H2O)6] 3+ 中含有的σ键数为 ______________。
(3)已知B、C两种元素形成的化合物通常有两种。这两种化合物中___________ (填化学式)为非极性分子。另一种物质的电子式为 ______________。
(4)D是一种硬而脆抗腐蚀性强的金属,常用于电镀和制造特种钢。下图为D的晶胞结构图,则D晶胞属于___________堆积;该晶胞中原子的体积占晶胞体积的百分率为___________。(已知:π=3.14,![]() =1.732)
=1.732)

(5)E晶体的一种晶胞(如图所示)的边长为anm,密度为ρg·cm-3,NA表示阿伏加德罗常数的值,则E的原子半径为___________nm,E的相对原子质量可表示为___________。

查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化氯(ClO2,黄绿色易溶于水的气体)是一种安全稳定、高效低毒的消毒剂。工业上通过惰性电极电解氯化铵和盐酸的方法制备,其原理如图所示:

下列说法不正确的是
A. b电极接电源的负极,在b极区流出的Y溶液是稀盐酸
B. 二氧化氯发生器中排出的X溶液中溶质主要为NaCl和NaOH
C. 电解过程中二氧化氯发生器中产生2.24L(标准状况)NH3,则b极产生0.6gH2
D. 电解池a极的电极反应式为NH4+-6e-+4OH-+3Cl-=NCl3+4H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】C、N、S和Cl元素的单质及化合物在工业生产中的有效利用备受关注。请回答下列问题:
(1)已知:I.2SO2(g)+O2(g)+2H2O(1) =2H2SO4(aq) △H1;
Ⅱ.Cl2(g)+H2O(1)![]() HCl(aq)+HClO(aq) △H2;
HCl(aq)+HClO(aq) △H2;
Ⅲ.2HClO(aq) =2HCl(aq)+O2(g) △H3
SO2(g)+Cl2(g)+2H2O(1)=2HCl(aq)+H2SO4 (aq) △H4=__________(用含有△H1、△H2和△H3的代数式表示)。
(2)25℃时,H2SO3溶液中各含硫微粒的物质的量分数(δ)与溶液pH的变化关系如图所示。

已知25℃时,NaHSO3的水溶液pH<7,用图中的数据通过计算解释原因 ____________________。
(3)利用“ Na-CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“ Na-CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2![]() 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:

①放电时,正极的电极反应式为______。
②选用高氯酸钠—四甘醇二甲醚做电解液的优点是_______(至少写两点)。
(4)氯氨是氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2C1、NHC12和NC13),副产物少于其它水消毒剂。
①一氯胺(NH2Cl)的电子式为_______。一氯胺是重要的水消毒剂,其原因是由于一氯胺在中性、酸性环境中会发生水解,生成具有强烈杀菌作用的物质,该反应的化学方程式为_______。
②在恒温条件下,2molCl2和1molNH3发生反应2Cl2(g)+NH3(g)![]() NHCl2(l)+2HCl(g),测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示:
NHCl2(l)+2HCl(g),测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示:

计算C点时该反应的压强平衡常数Kp(C)= _______ (Kp是平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
查看答案和解析>>
科目: 来源: 题型:
【题目】硼酸(H3BO3)为一元弱酸,已知H3BO3与足量NaOH溶液反应的离子方程式为:H3BO3+OH-=B(OH)4一,H3BO3可以通过电解的方法制备。其工作原理如下图所示(阳膜和阴膜分别只允许阳离子、阴离子通过)。下列说法正确的是
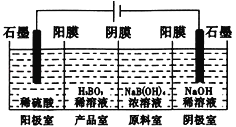
A. 当电路中通过1mol电子时,可得到lmolH3BO3
B. 将电源的正负极反接,工作原理不变
C. 阴极室的电极反应式为:2H2O-4e-=O2+4H+
D. B(OH)4一穿过阴膜进入阴极室,Na+穿过阳膜进入产品室
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com