
科目: 来源: 题型:
【题目】水煤气变换[CO(g)+H2O(g)![]() CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。回答下列问题:
CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。回答下列问题:
(1)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用![]() 标注。
标注。

该历程中决速步骤的化学方程式为__(方程式两边若有相同物料不用约简)。水煤气变换反应的热化学方程式为__。
(2)t1℃时,密闭容器中,通入一定量的CO和H2O,发生水煤气变换反应,容器中各物质浓度(单位:mol·L-1)变化如下表所示:
时间(min) | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | c1 | c2 | c3 | c3 |
4 | c1 | c2 | c3 | c3 |
5 | 0.116 | 0.216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
①一定处于平衡状态的时间段为__。
②5~6min时间段内,平衡移动方向为__(填“向左移动”或“向右移动”),根据表中数据判断,平衡移动的原因是__(填字母编号)。
a.增加了H2O(g)的量 b.增加氢气浓度 c.使用催化剂 d.降低温度
③t2℃时(t2>t1),在相同条件下发生上述反应,达平衡时,CO浓度__c1(填“>”“<”或“=”)。
(3)已知反应Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数随温度变化情况如图所示:
FeO(s)+CO(g)的平衡常数随温度变化情况如图所示:

①该反应是__(填“吸热”或“放热”)反应。
②若T1时水煤气变换反应的平衡常数等于0.5,则T1时FeO(s)+H2(g)![]() Fe(s)+H2O(g)的平衡常数为__。
Fe(s)+H2O(g)的平衡常数为__。
(4)水煤气可做燃料电池的燃料。一种熔融碳酸盐燃料电池的工作原理如图所示。电极A上H2参与的电极反应为__。假设催化炉产生的CO与H2物质的量之比为1︰2。电极A处产生的CO2有部分参与循环利用,其利用率为__。

查看答案和解析>>
科目: 来源: 题型:
【题目】黄血盐[亚铁氰化钾,K4Fe(CN)6]目前广泛用作食品添加剂(抗结剂),我国卫生部规定实验中黄血盐的最大使用量为10mg/kg。一种制备黄血盐的工艺如图:

回答下列问题:
(1)步骤Ⅰ制备的Ca2Fe(CN)6易溶于水吗?__(填“易溶”或“不易溶”)。
(2)步骤Ⅲ的化学方程式为__。
(3)步骤Ⅴ所用的试剂X是__(填化学式)。
(4)工艺中用到剧毒的HCN溶液,含CN-的废水必须处理后才能排放。
已知:HCN是一种具有苦杏仁味的无色剧毒液体,易挥发,25℃时Ka(HCN)=6.25×10-10;溶液中H2CO3、HCO3-、CO32-的存在与溶液pH的关系如图所示:

①HCN的电子式为__。
②处理含CN-废水的方法:第一步控制pH>10,用NaClO溶液先将CN-不完全氧化为OCN-;第二步控制pH为7.5~8.5,用NaClO溶液完全氧化OCN-生成N2和两种盐。第一步控制强碱性的主要目的是__,第二步反应的离子方程式为__。
(5)已知蓝色染料普鲁士蓝的合成方法如图:

用硫酸亚铁碱性试纸可以检验食品中是否含有CN-,方案如图:
![]()
若试纸变蓝则证明食品中含有CN-,基于普鲁士蓝的合成原理,请用离子方程式解释检测时试纸变蓝的原因:__。
查看答案和解析>>
科目: 来源: 题型:
【题目】乙醇分子中各种化学键如图所示。下列有关反应断键位置说明错误的是( )
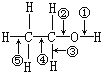
A.乙醇和浓硫酸,共热到170℃时断键②⑤
B.乙醇和浓硫酸,共热到140℃时断键①④
C.乙醇和金属钠的反应断键①
D.乙醇在Cu催化下与O2反应时断键①③
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室制取乙烯的发生装置如图所示。下列说法正确的是

A.烧瓶中加入乙醇、浓硫酸和碎瓷片
B.反应温度控制在140℃
C.导出的气体中只有乙烯
D.可用向上排气法收集乙烯
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物 YX2、ZX2 中,X、Y、Z 的核电荷数小于 18;X 原子最外能层的 p 能级中有一个轨道充填了 2 个电子,Y 原子的最外层中 p 能级的电子数等于前一能层电子总数,且X 和 Y 具有相同的电子层数;Z 与 X 在周期表中位于同一主族。回答下列问题:
(1)X 的电子排布式为______________,Y 的价电子轨道表示式为_______。
(2)ZX2 的分子式是_______,YX2 电子式是_______ 。
(3)Z 形成的简单阴离子的结构示意图是___________。
(4) Y 和 Z 一定条件下形成简单分子的结构式是___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:MOH碱性比NOH强。常温下,用HCl气体分别改变浓度均为0.1mol·L-1的MOH溶液和NOH溶液的pH(溶液体积变化忽略不计),溶液中M+、N+的物质的量浓度负对数与溶液的pH关系如下图,pR=-lgc(M+)或-lgc(N+),下列说法错误的是( )
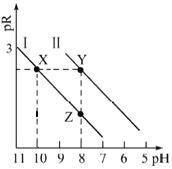
A.曲线I表示-lgc(M+)与pH关系
B.常温下,电离常数![]() =100
=100
C.溶液中水的电离程度:Y>X
D.对应溶液中c(Cl-):Y>Z
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)利用电化学原理,将 NO2、O2 和熔融 KNO3 制成燃料电池,模拟工业电解法来处理含 Cr2O72-废水,如下图所示;电解过程中溶液发生反应: Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2 O。
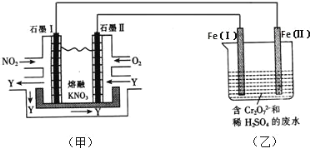
①甲池工作时,NO2 转变成绿色硝化剂 Y,Y 是 N2O5,可循环使用,则石墨Ⅱ附近发生的电极反应式为______。
②向完全还原为 Cr3+的乙池工业废水中滴加 NaOH 溶液,可将铬以 Cr(OH)3 沉淀的形式除去,已知 Cr(OH)3 存在以下溶解平衡:Cr(OH)(s)![]() Cr3+(aq)+3OH-(aq),常温下 Cr(OH)3 的溶度积 K=c(Cr3+)c(3OH-)=1.0×10-32,要使 c(Cr3+)降至 10-5molL-1,溶液的 pH 应调至___________。
Cr3+(aq)+3OH-(aq),常温下 Cr(OH)3 的溶度积 K=c(Cr3+)c(3OH-)=1.0×10-32,要使 c(Cr3+)降至 10-5molL-1,溶液的 pH 应调至___________。
(2)镉镍可充电电池在现代生活中有广泛应用,它的充、放电反应按下式进行: Cd+2NiO(OH)+H2O![]() Cd(OH)2+2Ni(OH)2
Cd(OH)2+2Ni(OH)2
回答下列问题:
①放电时,金属 Cd 作______极;
②充电时的阳极电极反应式为。_____
③充电时,当电路中通过 0.2moleˉ,阴极质量将___________(填“增加”、“减少”)___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学设计了一组电化学装置如图所示,其中乙装置中 X 为阳离子交换膜,甲醇(CH3OH)具有可燃性。
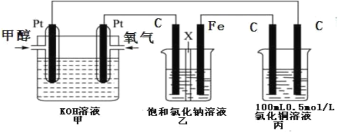
根据要求回答相关问题:
(1)写出装置甲中负极的电极反应式:________。
(2)装置乙中石墨电极(C)的电极反应式为:_________。
(3)当装置甲中消耗 0.05molO2 时,丙装置中阳极产生气体的体积 ____________L(标况下);
(4)若按(3)数据,装置乙中溶液的 pH 为_____________(溶液体积为 200mL 不变)。要使乙中溶液恢复到原来的状态,需要加入的物质是__________,对应用量为___________mol.
查看答案和解析>>
科目: 来源: 题型:
【题目】通过学习,同学们对宏观辨识与微观探析,变化观念与平衡思想等学科素养有了进一步的认识和理解。请根据所学知识回答下列问题:
(1)铅蓄电池是典型的可充电型电池,电池总反应式为:Pb+PbO2+4H++2SO42-![]() 2PbSO4 +2H2O。放电时,负极的电极反应式是_______;充电时,当外电路通过 0.2 mol 电子时,理论上正极板的质量减少_________g。
2PbSO4 +2H2O。放电时,负极的电极反应式是_______;充电时,当外电路通过 0.2 mol 电子时,理论上正极板的质量减少_________g。
(2)已知:常温下,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4×10-38。
①常温下,某酸性 MgCl2 溶液中含有少量的 FeCl3 ,为了得到纯净的 MgCl2·2H2O 晶体,应加入_________填化学式),调节溶液的 pH=4,使溶液中的 Fe3+转化为 Fe(OH)3沉淀,此时溶液中的 c(Fe3+)=_________mol·L-1。
②常温下,若将 0.01 mol·L-1 MgCl2 溶液与至少________mol·L-1 NaOH 溶液等体积混合时有沉淀生成。
(3)25℃时,几种离子开始沉淀时的 pH 如下表:
离子 | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
当向含相同浓度 Cu2+、Mg2+、Fe2+的溶液中滴加 NaOH 溶液时,__________先沉淀(填离子符号),要使 0.3mol·L-1 硫酸铜溶液中Cu2+沉淀较为完全(当 Cu2+浓度降至 10-5 mol·L-1时),则应向溶液里加入氢氧化钠溶液使溶液 pH 为________(KspCu(OH)2=1×10-20)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com