
科目: 来源: 题型:
【题目】按要求回答下列问题:
(1)某有机物的结构简式为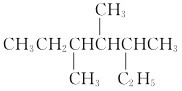
①该有机物系统命名法命名为____________ 。
②若该烷烃是由单炔烃和氢气加成得到的,则可能的单炔烃有________种。
③若该烷烃是由单烯烃和氢气加成得到的,则可能的烯烃有____种,任写一种烯烃的结构简式:________________________。
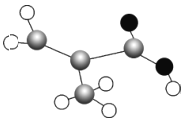
(2)某有机物只含C、H、O 三种元素,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等),该物质的结构简式为___________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】黄铜矿是一种铜铁硫化物,化学式为CuFeS2,它是工业上炼铜的主要原料。某化学小组对其中的硫、铁、铜的含量进行测定。
Ⅰ.硫的含量测定。
(1)采用装置A,在高温下将10.0g矿样中的硫转化为SO2。
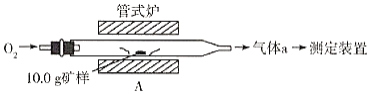
若在装置A反应中,氧化剂与还原剂的物质的量之比为19:6,灼烧后A中留下黑色固体,则反应的化学方程式为__________。
(2)将气体a通入测硫装置中(如图),然后采用沉淀法测定硫的含量。

①KMnO4溶液氧化SO2的离子方程式为________________。
②向反应后的溶液中加入过量的BaCl2溶液,过滤,洗涤沉淀并干燥,称重为23.3g,则该矿样中硫的质量分数为__________。
Ⅱ.铁、铜的含量测定。
向A中灼烧后的固体中加入稀硫酸,加热溶解,过滤,将滤液分为两等份。
(3)取其中一份加入过量的氨水生成沉淀{已知Cu(OH)2能溶于氨水生成[Cu(NH3)4]2+},过滤、洗涤、灼烧、称重为1.5 g。实验过程中,加入过量的氨水得到的沉淀是___________(填化学式);灼烧时除用到三脚架、酒精灯和玻璃棒外,还要用到________________。
(4)①将另一份溶液调至弱酸性,先加入NH4F,使Fe3+生成稳定的![]() ,其目的是_____
,其目的是_____
②加入过量KI溶液,使Cu2+生成CuI沉淀,同时析出定量的I2。
③再用1.00 molL-1 Na2S2O3标准溶液滴定生成的I2,以___________作指示剂。若消耗的Na2S2O3标准溶液为25.00 mL,则矿样中铜的质量分数是_________(已知I2 +2 Na2S2O3= Na2S4O6+2NaI)。
查看答案和解析>>
科目: 来源: 题型:
【题目】有机化合物M是一种治疗恶性肿瘤的合成药物。制备M的一种合成路线如图所示:

已知:  (R为烃基)。
(R为烃基)。
(1)A的化学名称是________。
(2)由A生成B和B生成C的反应类型分别是_________、________。
(3)由C生成D的化学方程式是____________________。
(4)写出E的结构简式:________,X是E的同分异构体,且X满足下列条件:
①能发生银镜反应;②遇浓FeCl3溶液变色;③分子结构中只含一个碳环结构。
符合上述条件的X有_____种,其中核磁共振氢谱显示有5种不同化学环境的氢,峰面积比为2:2:2:1:1的结构简式是_____________。
(5)根据题给信息,写出用CH3CHO和 为原料制备
为原料制备 的合成路线:_________________(其他试剂任选)。
的合成路线:_________________(其他试剂任选)。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用下图所示装置可确定有机物的化学式,其原理:在玻璃管内,用纯氧氧化管内样品,根据产物的质量确定有机物的组成。
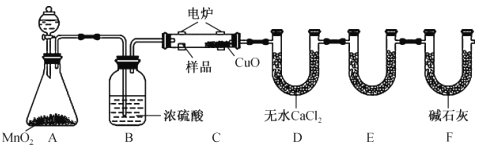
回答下列问题:
(1)装置B中的作用是____________________;若无B装置,则会造成测得的有机物中含氢量_________(填“偏大”“偏小”或“不变”)。
(2)装置E中所盛放的试剂是________ ,其作用为______________ 。
(3)若准确称取1.20g有机物(只含C、H、O 三种元素中的两种或三种),经充分燃烧后,E管质量增加1.76g,D管质量增加0.72g,则该有机物的最简式为_______________。
(4)要确定该有机物的分子式,还需要测定_________________ 。
(5)若该有机物的相对分子质量为60,核磁共振氢谱中有2组峰且面积比为3:1,则该有机物可能为乙酸或________ (填名称),可采取_______ 方法(填一种仪器分析法)确定该有机物具体是何种物质。
查看答案和解析>>
科目: 来源: 题型:
【题目】铁及其化合物广泛存在于人们的日常生活和工业生产中。回答下列问题:
(1)基态Fe原子的核外电子排布式是________,Ca元素与Fe元素同周期,灼烧![]() ,火焰为砖红色,节日中燃放的焰火配方中常含有Ca元素,灼烧Ca元素呈现特殊颜色的原因是____
,火焰为砖红色,节日中燃放的焰火配方中常含有Ca元素,灼烧Ca元素呈现特殊颜色的原因是____
(2)人体内血红蛋白的结构简式如图所示:
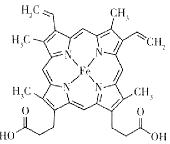
①组成血红蛋白的5种元素中,电负性由大到小的顺序是_________,C、N、O的第一电离能由大到小的顺序是_______。
②血红蛋白分子结构中N的杂化方式是_______。
③血红蛋白分子结构中含有配位键,为这些配位键提供孤电子对的元素是_______(写元素符号,下同),提供空轨道的元素是______。
(3)![]() 可应用于工业生产中的催化剂,其晶胞结构如图所示:
可应用于工业生产中的催化剂,其晶胞结构如图所示:
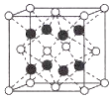
①已知电负性:Fe-1.83,Br-2.96,则![]() 中含有的化学键类型为_________。
中含有的化学键类型为_________。
②![]() 晶胞中铁的配位数是_________;
晶胞中铁的配位数是_________;![]() 晶胞边长为a cm,则
晶胞边长为a cm,则![]() 晶体密度的表达式为_____________
晶体密度的表达式为_____________![]() (设阿伏加德罗常数的值为NA)。
(设阿伏加德罗常数的值为NA)。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫化氢大量存在于天然气及液化石油气中,近年来发现![]() 可用于制取氢气、合成硫醇等。回答下列问题:
可用于制取氢气、合成硫醇等。回答下列问题:
(1)D.Berk等学者设计的用FeS催化分解![]() 包括下列反应:
包括下列反应:
Ⅰ.![]()
Ⅱ.![]()
Ⅲ.![]()
①![]() =____________(用
=____________(用![]() 表示)。
表示)。
②已知单质硫气态时以![]() 形式存在(结构为S=S)。键能E(H-S)=339
形式存在(结构为S=S)。键能E(H-S)=339![]() 、E(H-H)=436
、E(H-H)=436![]() 、E(S=S)=225
、E(S=S)=225![]() ,则
,则![]() =____________
=____________![]() 。
。
③![]() 是离子化合物,Fe显+2价,
是离子化合物,Fe显+2价,![]() 的电子式为______________。
的电子式为______________。
(2)银器长期露置在含![]() 的空气中表面会生成
的空气中表面会生成![]() 而变黑,该反应的氧化剂为________;将表面变黑的银器放在盛有食盐水的铝制容器中煮沸,表面重新变为光亮,正极发生的电极反应为________。
而变黑,该反应的氧化剂为________;将表面变黑的银器放在盛有食盐水的铝制容器中煮沸,表面重新变为光亮,正极发生的电极反应为________。
(3)实验室用粗锌制取氢气时常含有少量的![]() ,可用酸性
,可用酸性![]() 溶液(
溶液(![]() 被还原为
被还原为![]() )将
)将![]() 氧化为S而除去,该反应的离子方程式为_______。
氧化为S而除去,该反应的离子方程式为_______。
(4)![]() 与
与![]() 合成硫醇
合成硫醇![]() 的反应
的反应![]() 在不同温度及不同物质的量之比时
在不同温度及不同物质的量之比时![]() 的平衡转化率如图所示:
的平衡转化率如图所示:
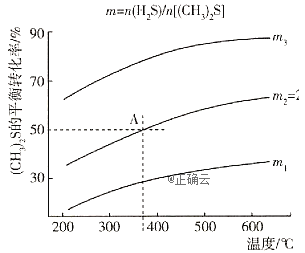
①该反应的![]() ______0(填“>”或“<");
______0(填“>”或“<");![]() _________
_________![]() (填“>”或“<”)。
(填“>”或“<”)。
②在2L密闭容器中充入0.2mol![]() 和0.1mol
和0.1mol![]() ,在A点达到平衡时,A点对应温度下反应的平衡常数为K=_________。
,在A点达到平衡时,A点对应温度下反应的平衡常数为K=_________。
③为提高![]() 的平衡转化率,除改变温度及投料比(m)外,还可采取的措施是_____
的平衡转化率,除改变温度及投料比(m)外,还可采取的措施是_____
查看答案和解析>>
科目: 来源: 题型:
【题目】锰及其化合物在现代工业、农业生产中有着广泛的应用,同时也是实验室中常用的重要试剂。
(1)KMnO4是强氧化剂,其溶液中c(H+)=c(OH-),则常温下0.01molL-1的HMnO4溶液的pH=_____________。
(2)MnS常用于除去污水中的Pb2+等重金属离子:Pb2+(aq)+ MnS(s)PbS(s)+Mn2+(aq),若经过处理后的水中c(Mn2+)=1 ×10-6 molL-1,则c(Pb2+)=______________[已知Ksp(PbS)=8×10-28、Ksp(MnS)=2×10-13]。
(3)锰是农作物生长的重要微量元素,用硫酸锰溶液拌种可使农作物产量提高10%~15%。某工厂利用回收的废旧锌锰干电池生成硫酸锰晶体(MnSO4H2O)的流程如图所示:
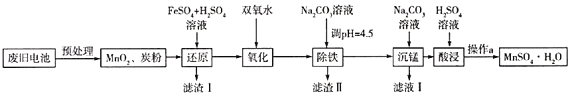
①MnSO4中含有的化学键类型有_______________。
②滤渣Ⅱ的主要成分是____________,滤渣Ⅰ是一种黑色单质,“还原”过程中氧化产物是Fe3+,写出相应反应的离子方程式_________,此反应中MnO2的转化率与温度之间的关系如图所示,则适宜的温度是______________(填字母)。
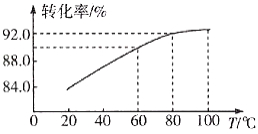
a.40 ℃ b.60 ℃ c.80 ℃ d.100 ℃
③“沉锰”中有无色无味的气体生成,还有MnCO36Mn(OH)25H2O生成,写出相应反应的化学方程式_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】目前大多数城市采用雨污分流的排水体制,污水汇集到一起,进行集中处理。如图是电解法处理某生活污水的装置:
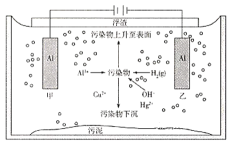
下列叙述正确的是( )
A.甲、乙两个电极均为消耗型电极,不能用石墨代替
B.电解开始时,阴极反应为2H2O+2e-=H2↑+2OH-,阴极区pH升高
C.当阳极有9.0gAl溶解时,阴极一定增重100.5g或32.0g
D.污水中污染物的除去是阳极反应与阴极反应协同作用的结果
查看答案和解析>>
科目: 来源: 题型:
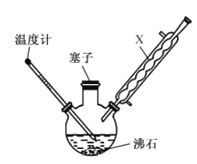
【题目】某同学在实验室以苯胺(密度:1.02g.mL—1)和浓硫酸为原料制备对氨基苯磺酸(![]() ),反应原理以及反应装置(加热及夹持仪器已省略)如下:
),反应原理以及反应装置(加热及夹持仪器已省略)如下:
![]() +H2SO4(浓)
+H2SO4(浓)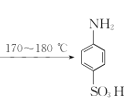 +H2O
+H2O
已知:100mL水在20C时可溶解对氨基苯磺酸1.08g,在100C时可溶解6.67g 。实验步骤:
I.在100mL三颈烧瓶中加入10mL苯胺及几粒沸石,将三颈烧瓶放入冷水中冷却,小心地加入20mL浓硫酸;
II.将三颈烧瓶置于加热装置中缓慢加热至170~180℃,维持此温度2~2.5h;
III.将反应液冷却至约50℃后,倒入盛有100mL冷水的烧杯中,用玻璃棒不断搅拌,促使晶体析出,抽滤,用少量冷水洗涤,得到对氨基苯磺酸粗产品;
VI.将粗产品用沸水溶解,冷却结晶,抽滤,收集产品,晾干得到16.2g对氨基苯磺酸。
回答下列问题:
(1)装置中,x的名称为______________ ,其作用是__________________ 。
(2)步骤II中,“加热装置”是 ________ (填“油浴”或“水浴”)装置。
(3)步骤III中,需用少量冷水洗涤对氨基苯磺酸粗产品的原因是________________ 。
(4)步骤VI,冷却结晶过程中,若溶液颜色过深,可用__________(填一种吸附剂)脱色。
(5)本实验中对氨基苯磺酸的产率为__________(结果保留两位小数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】通过下列装置(部分夹持仪器已省略)可制取1,2-二溴乙烷。下列说法正确的是( )
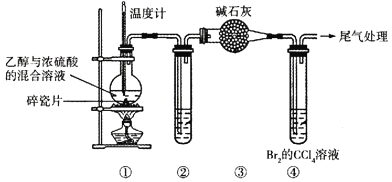
已知:烧瓶中反应后逸出的气体主要是CH2=CH2,含少量SO2、CO2及H2O(g)。
A.配制“乙醇与浓硫酸的混合溶液”时,将乙醇注入浓硫酸中并搅拌
B.②的试管中可盛放酸性KMnO4溶液以除去SO2
C.④中的Br2已完全与乙烯加成的现象是:溶液由橙色变为无色
D.可用分液漏斗从④反应后的混合物中分离出1,2-二溴乙烷并回收CCl4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com