
科目: 来源: 题型:
【题目】炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧。活化过程的能量变化模拟计算结果如右图所示。活化氧可以快速氧化 SO2。下列说法不正确的是
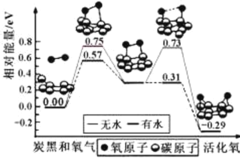
A.每活化一个氧分子放出0.29eV能量
B.水可使氧分子活化反应的活化能降低0.42eV
C.氧分子的活化是O-O的断裂与C-O键的生成过程
D.炭黑颗粒是大气中SO2转化为SO3的催化剂
查看答案和解析>>
科目: 来源: 题型:
【题目】科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半。下列叙述正确的是

A. WZ的水溶液呈碱性
B. 元素非金属性的顺序为X>Y>Z
C. Y的最高价氧化物的水化物是中强酸
D. 该新化合物中Y不满足8电子稳定结构
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式书写正确的是
A.Fe(OH)3 溶于氢碘酸:Fe(OH)3+3H+===Fe3++3H2O
B.K2S 溶液中加入AgCl 固体反应的离子方程式为:2AgCl+S2-===2Cl-+Ag2S
C.苯酚钠溶液中通入少量二氧化碳: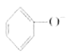 +CO2+H2O→
+CO2+H2O→![]() +CO32-
+CO32-
D.溴化亚铁溶液中通入足量氯气:2Fe2++2Br-+2Cl2===2Fe3++Br2+4Cl-
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,某化学兴趣小组设计了一个燃料电池,并探究氯碱工业原理和粗铜精炼原理,其中乙装置中X为阳离子交换膜。根据要求回答相关问题:

(1)通入氧气的电极为_____(填“正极”或“负极”),此电极反应式为_________。
(2)铁电极为_______(填“阳极”或“阴极”),乙装置中电解反应的化学方程式为_________________。
(3)某粗铜中含有铁、金、银和铂等杂质,通过电解精制后,为从电解液中制得硫酸铜晶体(CuSO4·5H2O),设计了如下工艺流程:
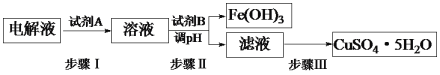
已知:几种金属阳离子开始沉淀和沉淀完全的pH。
氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
Fe3+ | 1.9 | 3.2 |
Fe2+ | 7.6 | 9.6 |
Cu2+ | 4.7 | 6.7 |
①步骤I中加入试剂A的目的是_____________________________,试剂A应选择______(填序号);
a.氯气 b.过氧化氢 C.酸性高锰酸钾溶液
②步骤II中试剂B为_________(答出一种即可),调节pH的范围是___________;
③步骤III的操作是加热浓缩、___________、过滤。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.无色透明的溶液中: Fe3+、Mg2+、SCN 、Cl
B.![]() =1×10-12的溶液中:K+、Na+、CO32、NO3
=1×10-12的溶液中:K+、Na+、CO32、NO3
C.![]() 的溶液中: K+、NH4+、MnO4、SO42-
的溶液中: K+、NH4+、MnO4、SO42-
D.能使甲基橙变红的溶液中: Na+、NH4+、SO42-、HCO3-
查看答案和解析>>
科目: 来源: 题型:
【题目】“中和滴定”原理在实际生产生活中应用广泛。用I2O5可定量测定CO的含量,该反应原理为5CO+I2O5![]() 5CO2+I2。其实验步骤如下:
5CO2+I2。其实验步骤如下:
①取250 mL(标准状况)含有CO的某气体样品,通过盛有足量I2O5的干燥管,在170 ℃下充分反应;
②用水-乙醇混合溶液充分溶解产物I2,配制100 mL溶液;
③量取步骤②中溶液25.00 mL于锥形瓶中,然后用0.01 mol·L-1的Na2S2O3标准溶液滴定。
(1)步骤②中配制100 mL待测溶液需要用到的玻璃仪器的名称是烧杯、量筒、玻璃棒、胶头滴管和____________________。
(2)Na2S2O3标准液应装在__________(填字母)中。

(3)指示剂应选用__________,判断达到滴定终点的现象是____________。(已知:气体样品中其他成分不与I2O5反应:2Na2S2O3+I2=2NaI+Na2S4O6)。
(4)下列操作会造成所测CO的体积分数偏大的是________(填字母)。
a.滴定终点俯视读数
b.锥形瓶用待测溶液润洗
c.滴定前有气泡,滴定后没有气泡
d.配制100 mL待测溶液时,有少量溅出
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上常用天然气作为制备甲醇CH3OH的原料。已知:
①CH4(g)+O2(g)CO(g)+H2(g)+H2O(g)△H=-321.5kJ/mol
②CH4(g)+H2O(g)CO(g)+3H2(g)△H=+250.3kJ/mol
③CO(g)+2H2(g)CH3OH(g)△H=-90kJ/mol
(1)CH4(g)与O2(g)反应生成CH3OH(g)的热化学方程式为______。
(2)向VL恒容密闭容器中充入a mol CO与2a molH2,在不同压强下合成甲醇。CO的平衡转化率与温度、压强的关系如图所示:

①压强P1______P2(填“<”、“>”或“=”)
②在100℃、P1压强时,平衡常数为______(用含a,V的代数式表示)。
(3)甲醇燃料电池往往采用KOH(或NaOH)浓溶液作电解质溶液,电极采用多孔石墨棒,两个电极上分别通入甲醇和氧气。通入氧气的电极为:通入甲醇的电极上发生的电极反应为:______。用此燃料电池电解某浓度氯化钠溶液,电解一段时间后,收集到标准状况下氢气3.36L,此时燃料电池所消耗的CH3OH的质量为:______。
(4)常温下,0.1mol/LNaHCO3溶液的pH大于8,则溶液中C(H2CO3)______C(CO32-)(填“<”、“>”或“=”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是

A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是
A. 32 g S8(分子结构:![]() )中的共价键数目为NA
)中的共价键数目为NA
B. 2 g由H218O和2H2O组成的物质中含有的质子数为NA
C. 8 g CuO与足量H2充分反应生成Cu,该反应转移的电子数为0.2NA
D. 标准状况下,11.2 L Cl2溶于水,溶液中Cl-、ClO-和HClO的微粒数之和为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,取0.2 mol·L-1 HX溶液与0.2 mol·L-1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则下列关于混合溶液的说法(或关系式)正确的是
A.c(Na+)-c(X-)=9.9×10-7 mol·L-1
B.c(Na+)=c(X-)+c(HX)=0.2 mol·L-1
C.c(OH-)-c(HX)=c(H+)=1×10-6 mol·L-1
D.c(Na+)>c(X-)>c(HX)>c(OH-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com