
科目: 来源: 题型:
【题目】溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物。某同学依据溴乙烷的性质,用如图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究。
实验操作i:在试管中加入5mL1mol/LNaOH溶液和5mL溴乙烷,振荡。
实验操作ii:将试管如图固定后,水浴加热。
(1)试管口安装一长导管的作用是__。
(2)观察到__现象时,表明溴乙烷与NaOH溶液已完全反应。
(3)溴乙烷与NaOH乙醇溶液共热发生的是消去反应,写出该反应的方程式___。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学课外小组用如图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。
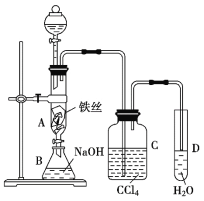
(1)反应后观察到A中反应液微沸,有红棕色气体充满A容器,写出A中反应的化学方程式__;
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是__;
(3)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入__溶液,若产生淡黄色沉淀,则能证明。
查看答案和解析>>
科目: 来源: 题型:
【题目】对于苯乙烯(![]() )的下列叙述:①能使酸性KMnO4溶液褪色,②可发生加聚反应,③可溶于水,④可溶于苯中,⑤苯环能与溴水发生取代反应,⑥所有的原子可能共面。其中完全正确的是( )
)的下列叙述:①能使酸性KMnO4溶液褪色,②可发生加聚反应,③可溶于水,④可溶于苯中,⑤苯环能与溴水发生取代反应,⑥所有的原子可能共面。其中完全正确的是( )
A.①②④⑥B.①②④⑤⑥C.①②④D.①②③④⑤⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】原子序数逐渐增大的A、B、C、D、E五种短周期主族元素的部分信息如下表:
元素代号 | 信息 |
A | 原子的最外层电子数为内层电子总数的3倍 |
B | 金属性最强的短周期元素 |
C | 原子的最外层电子数是次外层的 |
D | 原子是最外层电子数A原子的最外层电子数的一半 |
E | 最高价氧化物对应的水化物是最强的无机酸 |
请根据以上信息回答问题。
(1)C的氧化物的化学式为_______________A原子结构示意图为_______________。
(2)B、C、D形成的单质的熔点从低到高的顺序为_______________(填元素符号)。
(3)A、C所形成的化合物的晶体结构与氯化钠晶体结构相似,则晶胞中每个阳离子周围等距且紧邻的阴离子数目为_______________,晶体中阴、阳离子个数比为_______________。
(4)A、D所形成晶体的熔点比C、E所形成晶体的熔点_______________(填“高”或“低”),原因是_______________
查看答案和解析>>
科目: 来源: 题型:
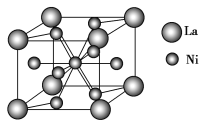
【题目】金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(1)Ni原子的核外电子排布式为____________________;
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO________FeO(填“<”或“>”);
(3)NiO晶胞中Ni和O的配位数分别为________、________;
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图所示。该合金的化学式为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】过氧乙酸(CH3COOOH)是一种高效消毒剂,性质不稳定遇热易分解,可利用高浓度的双氧水和冰醋酸反应制得,某实验小组利用该原理在实验室中合成少量过氧乙酸。装置如图所示。回答下列问题:
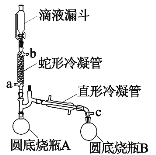
已知:①常压下过氧化氢和水的沸点分别是158℃和100℃。
②过氧化氢易分解,温度升高会加速分解。
③双氧水和冰醋酸反应放出大量的热。
(1)双氧水的提浓:蛇形冷凝管连接恒温水槽,维持冷凝管中的水温为60℃,c口接抽气泵,使装置中的压强低于常压,将滴液漏斗中低浓度的双氧水(质量分数为30%)滴入蛇形冷凝管中。
①蛇形冷凝管的进水口为___________。
②向蛇形冷凝管中通入60℃水的主要目的是________。
③高浓度的过氧化氢最终主要收集在______________(填圆底烧瓶A/圆底烧瓶B)。
(2)过氧乙酸的制备:向100mL的三颈烧瓶中加入25mL冰醋酸,滴加提浓的双氧水12mL,之后加入浓硫酸1mL,维持反应温度为40℃,磁力搅拌4h后,室温静置12h。
①向冰醋酸中滴加提浓的双氧水要有冷却措施,其主要原因是__________。
②磁力搅拌4h的目的是____________。
(3)取V1mL制得的过氧乙酸溶液稀释为100mL,取出5.0mL,滴加酸性高锰酸钾溶液至溶液恰好为浅红色(除残留H2O2),然后加入足量的KI溶液和几滴指示剂,最后用0.1000mol/L的Na2S2O3溶液滴定至终点,消耗标准溶液V2mL(已知:过氧乙酸能将KI氧化为I2;2Na2S2O3+I2=Na2S4O6+2NaI)。
①滴定时所选指示剂为_____________,滴定终点时的现象为___________。
②过氧乙酸与碘化钾溶液反应的离子方程式为_________。
③制得过氧乙酸的浓度为________mol/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】铁、铝、铜三种金属元素在日常生活中的应用最为广泛。回答下列问题:
(1)基态Fe原子的简化电子排布式为__________。
(2)常温下,Fe(CO)5为黄色液体,易溶于非极性溶剂。写出CO的电子式_________;Fe(CO)5分子中σ键与π键之比为_______。
(3)硝酸铜溶于氨水形成[Cu(NH3)4](NO3)2的深蓝色溶液。
①[Cu(NH3)4](NO3)2中阴离子的立体构型是_______。NO3-中心原子的轨道杂化类型为________。
②与NH3互为等电子体的一种阴离子为_______(填化学式);氨气在一定的压强下,测得的密度比该压强下理论密度略大,请解释原因________。
(4)金属晶体可看成金属原子在三维空间中堆积而成,单质铝中铝原子采用铜型模式堆积,原子空间利用率为74%,则铝原子的配位数为________________。
(5)铁和硫形成的某种晶胞结构如图所示,晶胞参数a=xpm,则该物质的化学式为_______;A原子距离B原子所在立方体侧面的最短距离为______pm(用x表示);该晶胞的密度为____g·cm-3。(阿伏加德罗常数用NA表示)
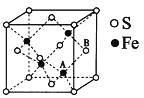
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)汽车尾气中的CO、NO、NO2等有毒气体会危害人体健康,可在汽车尾部加催化转化器,将有毒气体转化为无毒气体。
已知:①2NO(g)+O2(g)=2NO2(g) △H1=-112.3kJ·mol-1
②NO2(g)+CO(g)=NO(g)+CO2(g) △H2=-234kJ·mol-1
③N2(g)+O2(g)=2NO(g) △H3=+179.5kJ·mol-1
请写出CO和NO2生成无污染气体的热化学方程式___。
(2)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H=-759.8kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如图1。
N2(g)+2CO2(g) △H=-759.8kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如图1。

①b点时,平衡体系中C、N原子个数之比接近___;
②a、b、c三点CO的转化率从大到小的顺序为___;a、c、d三点的平衡常数从大到小的顺序为___。
③若n(CO)/n(NO)=0.8,反应达平衡时,N2的体积分数为20%,则CO的转化率为__。
(3)若将NO2与O2通入甲中设计成如图2所示装置,D电极上有红色物质析出,则A电极处通入的气体为____(填化学式);A电极的电极反应式为____;一段时间后,若乙中需加0.2molCu(OH)2使溶液复原,则转移的电子数为___。
(4)已知:25℃时,H2C2O4的电离常数Ka1=5.9×10—2,Ka2=6.4×10-5,则25℃时,0.1mol·L-1NaHC2O4溶液中各离子浓度由大到小的顺序为____,若向该溶液中加入一定量NaOH固体,使c(HC2O4-)=c(C2O42-),则此时溶液呈___(填“酸性”“碱性”或“中性”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】25 ℃时,将0.10 mol·L-1 CH3COOH溶液滴加到10mL 0.10mol·L-1NaOH溶液中,lg![]() 与pH的关系如图所示,C点坐标是(6,1.7)。(已知:lg5=0.7)下列说法正确的是
与pH的关系如图所示,C点坐标是(6,1.7)。(已知:lg5=0.7)下列说法正确的是
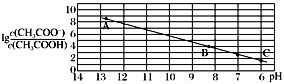
A.Ka(CH3COOH)=5.0×10-5
B.Ka(CH3COOH)=5.0×10-6
C.pH=7时加入的醋酸溶液的体积小于10 mL
D.B点存在c(Na+)-c(CH3COO-)=(10-6-10-8)mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com