
科目: 来源: 题型:
【题目】磷酸氯喹是一种抗疟疾药物, 研究发现,该药在细胞水平上能有效抑制新型冠状病毒的感染。其合成路线如下:
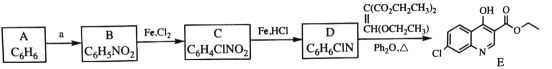

已知:

回答下列问题:
(1)A是一种芳香经, B 中官能团的名称为__________________。
(2)反应 A→B 中须加入的试剂a 为___________________。
(3)B 反应生成 C 的反应化学反应方程式是______________________。
(4)C→D 反应类型是_________, D的结构简式为_______________。
(5)F→G反应类型为________________。
(6)I是E的同分异构体,与E 具有相同的环状结构, 写出任意一种符合下列条件的I的结构简式是__________________________。
①I是三取代的环状有机物, 氯原子和羟基的取代位置与E相同;
②核磁共振氢谱显示I 除了环状结构上的氢外,还有4组峰, 峰面积比3:1:1:1;
③I加入NaHCO3溶液产生气体。
查看答案和解析>>
科目: 来源: 题型:
【题目】碳及其化合物广泛存在于自然界。随着科技的进步,利用化学反应原理将含碳物质进行合理转化,已成为资源利用、环境保护等社会关注问题的焦点。如CO2是人类工业生产排放的主要的温室气体,利用CO2制造更高价值化学品是目前的研究热点。
(1)①利用CH4和CO2这两种温室气体可以生产水煤气。已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H =![]() 890.3 kJ·mol-1
890.3 kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g) △H =+2.8 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H =![]() 566.0 kJ·mol-1
566.0 kJ·mol-1
反应CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g) 的△H =____kJ·mol-1
2CO(g)+2H2(g) 的△H =____kJ·mol-1
②250℃时,以镍合金为催化剂,向4 L恒容容器中通入6 mol CO2、6 mol CH4,发生如下反应:CO2 (g)+CH4(g) ![]() 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
物质 | CH4 | CO2 | CO | H2 |
体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
此温度下该反应的平衡常数K=_______。
(2)利用CO2催化加氢可以合成乙醇,反应原理为:2CO2(g)+6H2(g) ![]() C2H5OH(g)+3H2O(g) H<0,设m为起始时的投料比,即m= n(H2)/ n(CO2)。
C2H5OH(g)+3H2O(g) H<0,设m为起始时的投料比,即m= n(H2)/ n(CO2)。
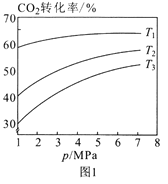
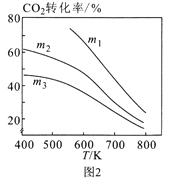
①图1中投料比相同,温度从高到低的顺序为____。
②图2中m1、m2、m3从大到小的顺序为____。
(3)高温电解技术能高效实现下列反应:CO2+H2O ![]() CO+H2+O2,其可将释放的CO2转化为具有工业利用价值的产品。工作原理示意图如下:
CO+H2+O2,其可将释放的CO2转化为具有工业利用价值的产品。工作原理示意图如下:
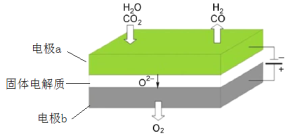
电极a的电极反应式____
(4)工业生产烟气中的CO2捕获技术之一是氨水溶液吸收技术,将烟气冷却至15.5℃~26.5℃后用氨水吸收过量的CO2。已知:NH3·H2O的Kb=1.7×10-5,H2CO3的Ka1=4.3×10-7、Ka2=5.6×10-11。吸收后所得溶液的pH____7(填“>”、“=”或“<”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】钴的化合物在工业生产、生命科技等行业有重要应用。
(1)Co2+的核外电子排布式为_______,Co的第四电离能比 Fe 的第四电离能要小得多,原因是__________________________。
(2)Co2+ 、Co3+都能与 CN一形成配位数为6的配离子。CN一中碳原子的杂化方式为____________;HCN分子中含有![]() 键的数目为__________________。
键的数目为__________________。
(3)用KCN处理含Co2+的盐溶液 ,有红色的Co(CN)2 析出,将它溶于过量的KCN溶液后,可生成紫色的[Co(CN)6] 4- ,该配离子是一种相当强的还原剂,在加热时能与水反应生成[Co(CN )6]3-,写出该反应的离子方程式:_______________。
(4)金属钴的堆积方式为六方最密堆积,其配位数是 _____。有学者从钴晶体中取出非常规的“六棱柱”晶胞,结构如图所示,该晶胞中原子个数为_____,该晶胞的边长为a nm,高为c nm,该晶体的密度为___gcm-3(NA表示阿伏加德罗常数的值,列出代数式)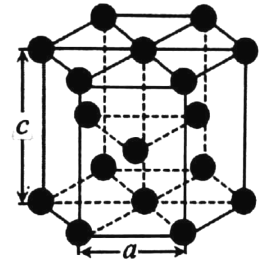
查看答案和解析>>
科目: 来源: 题型:
【题目】相同温度、相同容积的四个密闭容器中进行同样的可逆反应:2X(g)+Y(g)![]() 3W(g)+2Z(g) △H=﹣Q KJ/mol,起始时充入气体的物质的量及平衡时体系能量变化数据如表,下列说法正确的是( )
3W(g)+2Z(g) △H=﹣Q KJ/mol,起始时充入气体的物质的量及平衡时体系能量变化数据如表,下列说法正确的是( )
X | Y | W | Z | 反应体系能量变化 | |
甲 | 2mol | 1mol | 放出a kJ/mol | ||
乙 | 1mol | 1mol | 放出b kJ/mol | ||
丙 | 2mol | 2mol | 放出c kJ/mol | ||
丁 | 3mol | 2mol | 吸收d kJ/mol |
A.X的转化率为:甲<乙<丙
B.c+d<Q
C.平衡时,甲容器中的反应速率比丁容器中的慢
D.平衡时丙容器中Z的物质的量浓度最大
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是
A. 0.1 mol·L-1 (NH4)2Fe(SO4)2溶液中:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)
B. pH=11的氨水和pH=3的盐酸溶液等体积混合,所得溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C. 在0.1 mol·L-1 Na2CO3溶液中:2c(Na+)=c(CO![]() )+c(HCO
)+c(HCO![]() )+c(H2CO3)
)+c(H2CO3)
D. 0.1 mol·L-1的醋酸钠溶液20 mL与0.1 mol·L-1盐酸10 mL混合后溶液显酸性:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】汽车尾气中的CO和NO在排放时会发生复杂的化学反应。回答下列问题:
(1)通过NO传感器可监测汽车排放尾气中NO含量, 其工作原理如图所示。
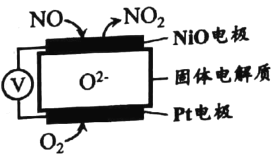
该传感器正极的电极反应式为 _________________。
(2)已知如下发生反应:
①2CO(g)+O2(g)=2CO2(g) △H1 =-606.6 kJ·mol-1
②2NO(g)+O2(g)=2NO2(g) △H2= -114.1 kJ·mo l-1
则反应CO(g) +NO2(g) = CO2(g) +NO(g)的△H =__________kJmo l-1
(3)300K时,将等浓度的CO 和 NO2混合加入刚性密闭容器中,发生反应CO(g) +NO2(g) = CO2(g) +NO(g), 测得 c(CO)浓度随时间t 的变化如表所示。
t/min | 0 | 20 | 90 | 170 | 560 | 1600 | 13200 | 14000 | ∞ |
c(CO)/mol·L-1 | 0.100 | 0.075 | 0.055 | 0.047 | 0.034 | 0.025 | 0.013 | 0.013 | 0.013 |
①300K时反应的平衡转化率α=_______%。平衡常数K=_______(保留1 位小数)。
②在300K下: 要提高CO转化率, 可采取的措施是_____________;要缩短反应达到平衡的时间,可采取的措施有______________、____________________。
③实验测得:反应物浓度按任意比时,该反应的正反应速率均符合v正=k正c2(NO2)。其中:k正为正反应速率常数,是与平衡常数K类似的只受温度影响的常数。请推理出v逆的表达式:v逆=_____________ (用k正 、 K 与c(CO)、c(CO2 )、c(NO)表达)。
④根据v逆的表达式 ,一定温度下,当反应达平衡后, t1时刻增大CO浓度, 平衡发生移动,下列图像正确的是______________。
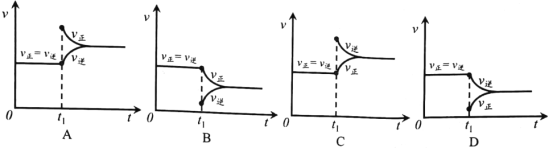
查看答案和解析>>
科目: 来源: 题型:
【题目】在相同温度下,0.01mol/L的NaOH溶液和0.01mol/L的盐酸相比较,下列说法正确的是( )
A.两溶液的pH之和等于14
B.由水电离出的c(H+)都是1.0×10-12mol/L
C.由水电离出的c(OH-)相等
D.若将0.01mol/L的盐酸换成同浓度的醋酸,对水的电离的影响不变
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列实验操作和现象所得到的结论正确的是( )
选项 | 实验操作和现象 | 结 论 |
A | 含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
B | 用铂丝蘸取少量NaCl溶液进行焰色反应,火焰呈黄色 | 这是钠离子的发射光谱 |
C | NaI溶液 | 酸性条件下H2O2的氧化性比I2强 |
D | 向浓度均为0.1 mol·L-1的NaCl和NaI混合溶液中滴加少量AgNO3溶液,先出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】辉铜矿主要成分为Cu2S,软锰矿主要成分为MnO2,它们都含有少量 SiO2、Fe2O3等杂质。工业上综合利用这两种矿物制备碳酸锰和硝酸铜晶体的主要工艺流程如图所示 :

已知:①部分金属阳离子生成氢氧化物沉淀的 pH范围如下表所示(开始沉淀的pH 按金属离子浓度为 0. l mol/L 计算)
开始沉淀的 pH | 沉淀完全的pH | |
Fe3+ | 1.1 | 3.2 |
Mn2+ | 8.3 | 9.8 |
Cu2+ | 4.4 | 6.4 |
②100.8≈6.3
(1)酸浸时,下列措施能够提高浸取速率的措施是__________________ 。
A.将矿石粉碎 B.适当延长酸浸时间 C.适当升高温度
(2)酸浸时, MnO2 与Cu2S反应的离子方程式是 __________________。
(3)浸出液调节pH = 4 的目的是_____________________ ,浸出液中铜离子浓度最大不能超过_______________ molL-1(保留一位小数)。
(4)生成 MnCO3 沉淀的离子方程式是_______________________。
(5)本工艺中可循环使用的物质是 ___________________(写化学式)。
(6)流程中需要加入过量HNO3溶液,除了使 Cu2(OH)2CO3完全溶解外,另一作用是蒸发结晶时_______________________。
(7)制得的Cu(NO3)2 晶体需要进一步纯化, 其实验操作名称是______________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】若在一定条件下,容积恒定的反应室中充入amolCO与2amolH2,在催化剂作用下发生反应CO(g)+2H2(g)![]() CH3OH(g),下列措施一定使
CH3OH(g),下列措施一定使![]() 增大的是( )
增大的是( )
A.升高温度B.充入Ar(g)使体系的总压增大
C.恒温恒容再充入H2D.恒温恒容再充入amolCO和2amolH2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com