
科目: 来源: 题型:
【题目】原子核外p能级、d能级等原子轨道上电子排布为“全空”“半满”“全满”的时候一般更加稳定,称为洪特规则的特例。下列事实不能作为这个规则的证据的是( )
A.硼元素的第一电离能小于铍元素的第一电离能
B.磷元素的第一电离能大于硫元素的第一电离能
C.基态铜原子的核外电子排布式为![]() 而不是
而不是![]()
D.某种激发态碳原子的核外电子排布式为![]() 而不是
而不是![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】前四周期元素![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 的原子序数依次增大。
的原子序数依次增大。![]() 与
与![]() 同周期且相邻的非金属元素,
同周期且相邻的非金属元素,![]() 的基态原子的s电子数与p电子数相等,
的基态原子的s电子数与p电子数相等,![]() 是地壳中含量最多的金属元素,
是地壳中含量最多的金属元素,![]() 的原子核外价电子排布式为
的原子核外价电子排布式为![]() ,
,![]() 的基态原子的未成对电子数是同周期元素中最多的。下列说法错误的是
的基态原子的未成对电子数是同周期元素中最多的。下列说法错误的是
A.简单气态氢化物的稳定性:![]()
B.简单离子的半径:![]()
C.![]() 的最高价氧化物对应的水化物既能与强酸反应,又能与强碱反应
的最高价氧化物对应的水化物既能与强酸反应,又能与强碱反应
D.由![]() 、
、![]() 、
、![]() 三种元素形成的某种化合物可用于检查司机是否酒后驾车
三种元素形成的某种化合物可用于检查司机是否酒后驾车
查看答案和解析>>
科目: 来源: 题型:
【题目】电化学技术在工业生产中有着重要的作用。请回答:
(1)氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀一层细小的铂粉。铂吸附气体的能力强,性质稳定。
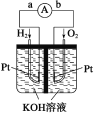
①氢氧燃料电池能量转化的主要形式是__。
②负极反应式为__。
③电极表面镀铂粉的原因是__。
(2)工业级氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。
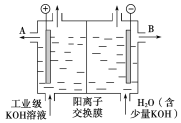
①该电解槽的阳极反应式是___。
②通电开始后,阴极附近溶液pH会增大,请简述原因___。
③除去杂质后的氢氧化钾溶液从液体出口___(填写“A”或“B”)导出。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇是重要的化工原料,利用合成气(CO、H2、CO2)在催化剂的作用下合成甲醇,可能发生的反应如下:
①CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1=-49.58kJ/mol K1
CH3OH(g)+H2O(g) ΔH1=-49.58kJ/mol K1
②CO(g)+2H2(g)![]() CH3OH(g) ΔH2=-90.77 kJ/mol K2
CH3OH(g) ΔH2=-90.77 kJ/mol K2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH3 K3
CO(g)+H2O(g) ΔH3 K3
(1)反应③的ΔH3=________,化学平衡常数K3与K1、K2的代数关系是K3=_____。
(2)要使反应②的速率和转化率都增大,需要改变的条件是___________。在5MPa下,要提高反应②的转化率,可采取的措施有__________、_________(答两条)。
(3)若反应①在恒容密闭容器中进行,下列可以判断该反应达到平衡的是_______(填标号)。
A.v正(H2)=v逆(CH3OH) B.混合气压强不变
C.c(H2)与c(H2O)比值不变 D.混合气密度不变
(4)在一定温度和催化剂存在下,向1L密闭容器中充入1molCO2和3molH2发生反应①。当CO2的平衡转化率为50%时,产物甲醇的体积分数为________,该温度下,正反应的平衡常数K=__________。若向容器中再充入0.5molH2和0.5molH2O(g),其他条件不变时平衡_______移动(填“正向”“逆向”“不”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】运用所学知识回答下列问题:
(1)常温下实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式:___。
(2)晶体硅在氧气中燃烧的热化学方程式为Si(s)+O2(g)=SiO2(s) ΔH=-989.2kJ·mol-1,有关键能数据如下表:
化学键 | Si—O | O=O | Si—Si |
键能/kJ·mol-1 | x | 498.8 | 176 |
已知1molSi中含2molSi—Si键,1molSiO2中含4molSi—O键,则x的值为__。
(3)AgNO3的水溶液呈___(填“酸”、“中”、“碱”)性,实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,目的是___。
(4)在稀释醋酸的过程中,下列始终保持增大趋势的量是(______)
A.c(H+) B.H+个数 C.CH3COOH分子数 D.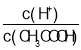
(5)某温度(t℃)时,水的离子积为Kw=1×10-13。若将此温度下pH=11的苛性钠溶液aL与pH=1的稀硫酸bL混合(设混合后溶液体积的微小变化忽略不计),若所得混合溶液的pH=2,则a∶b=__。
(6)已知Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)![]() Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol·L-1,溶液的pH应至少调至__。
Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol·L-1,溶液的pH应至少调至__。
查看答案和解析>>
科目: 来源: 题型:
【题目】700℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1):
CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说法正确的是
A. 反应在t1 min内的平均速率为v(H2)=![]() mol·L-1·min-1
mol·L-1·min-1
B. 保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,达到平衡时n(CO2)=0.40mol
C. 保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率不变,H2O的体积分数不变
D. 温度升高至800 ℃,上述反应平衡常数为0.64,则正反应为放热反应
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.将AlCl3溶液和Al2(SO4)3溶液分别加热、蒸干、灼烧,所得固体成分相同
B.洗涤油污常用热的纯碱溶液
C.用加热的方法可以除去KCl溶液中的Fe3+
D.配制FeSO4溶液时,将FeSO4固体溶于稀盐酸中,然后稀释至所需浓度
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,在1L0.1mol·L-1的CH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO-+H+,对于该平衡,下列叙述正确的是( )
CH3COO-+H+,对于该平衡,下列叙述正确的是( )
A.加入水时,平衡向逆反应方向移动
B.加入少量NaOH固体,平衡向正反应方向移动
C.加入少量0.1mol·L-1HCl溶液,溶液中c(H+)减小
D.加入少量CH3COONa固体,平衡向正反应方向移动
查看答案和解析>>
科目: 来源: 题型:
【题目】下列电离或水解方程式中,正确的是( )
A.NH4++H2O![]() NH3·H2O+H+
NH3·H2O+H+
B.NaHCO3=Na++H++CO32-
C.H2S![]() 2H++S2-
2H++S2-
D.CH3COOH+H2O=CH3COO-+H3O+
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.在纯水中加入盐一定促进水的电离
B.同温时,等浓度的NaHCO3和Na2CO3溶液,NaHCO3溶液的pH大
C.加热CH3COONa溶液,溶液中![]() 的值将变大
的值将变大
D.0.1mol·L-1HA弱酸溶液与0.05mol·L-1NaOH溶液等体积混合,所得溶液中:2c(H+)+c(HA)=c(A-)+2c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com