
科目: 来源: 题型:
【题目】pC类似pH,是指极稀溶液中,溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为1×10-3mol·L-1,则该溶液中溶质的pC=-lg(1×10-3)=3。如图为H2CO3在加入强酸或强碱溶液后,平衡时溶液中三种成分的pC-pH图。下列说法不正确的是

A. H2CO3、HCO3-、CO32-不能在同一溶液中大量共存
B. H2CO3电离平衡常数Ka1≈10-6
C. pH=7时,溶液中存在关系c(HCO![]() )>c(H2CO3)>c(CO
)>c(H2CO3)>c(CO![]() )
)
D. pH=9时,溶液中存在关系c(H+)+c(H2CO3)=c(OH-)+c(CO![]() )
)
查看答案和解析>>
科目: 来源: 题型:
【题目】滴定实验是化学学科中重要的定量实验。请回答下列问题:
I.酸碱中和滴定——用标准盐酸滴定未知浓度的NaOH溶液。
(1)该学生的实验操作如下:
a.用碱式滴定管取稀NaOH25.00mL,注入锥形瓶中,加入甲基橙做指示剂。
b.用待测定的溶液润洗碱式滴定管。
c.用蒸馏水洗干净滴定管。
d.取下酸式滴定管用标准的HCl溶液润洗后,将标准液注入滴定管刻度“0”以上2~3cm处,再把滴定管固定好,调节液面至刻度“0”或“0”刻度以下。
e.检查滴定管是否漏水。
f.另取锥形瓶,再重复操作一次。
g.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是(用序号填写)__→c→__→__→d→__→___。
②某次滴定前、后的盛放盐酸滴定管中液面的位置。请回答:
仪器A的名称是__;盐酸的体积读数:滴定前读数为__mL,滴定后读数为____mL;

③在G操作中如何确定终点___。
(2)下列操作造成测定结果偏高的是___(填选项字母)
A.滴定终点时,俯视滴定管溶液液面
B.盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗
C.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗
D.滴定前,滴定管尖嘴有气泡,滴定后气泡消失
II.氧化还原滴定—取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1mol/L的高锰酸钾溶液滴定,发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O。表格中记录了实验数据:
滴定次数 | 待测液体积(mL) | 标准KMnO4溶液体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 25.00 | 0.50 | 20.40 |
第二次 | 25.00 | 3.00 | 23.00 |
第三次 | 25.00 | 4.00 | 24.10 |
(1)滴定时,KMnO4溶液应装在___(“酸”或“碱”)式滴定管中,滴定终点时滴定现象是___。
(2)该草酸溶液的物质的量浓度为___。
查看答案和解析>>
科目: 来源: 题型:
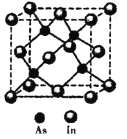
【题目】法医常用马氏试砷法检验是否砒霜( As2O3)中毒,涉及的反应如下:
I:6Zn+As2O3+12HCl=6ZnCl2+2AsH3(砷烷)↑+3H2O
Ⅱ:2AsH3=2As(黑色砷镜)+3H2
(1)写出砷的基态原子价电子排布图______________。
(2)砷烷的空间结构为_______;砷烷中心原子杂化方式为________。
(3)砷烷同族同系列物质相关性质如下表:
NH3 | PH3 | AsH3 | SbH3 | |
熔点/℃ | -77.8 | -133.5 | -116.3 | -88 |
沸点/℃ | -34.5 | -87.5 | -62.4 | -18.4 |
从PH3→AsH3→SbH3熔沸点依次升高的原因是_________;NH3分子例外的原因是_______。
(4)第一电离能数据I(As)>I(Se),可能的原因是_____________。
(5)砷与铟(In)形成的化合物(X)具有优良的光电性能,广泛应用于光纤通信用激光器,其晶胞结构如图所示,则其化学式为______;晶胞边长a= 666.67pm,则其密度为_____g/cm3(边长a可用![]() 近似计算,设NA=6.0×1023/mol)。
近似计算,设NA=6.0×1023/mol)。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列化合物:①NaOH,②H2SO4,③CH3COOH,④NaCl,⑤CH3COONa,⑥NH4Cl,⑦CH3COONH4,⑧NH4H2SO4,⑨NH3·H2O,请回答下列问题:
(1)若浓度均为0.1mol·L-1、等体积的NaOH和NH3·H2O分别加水稀释m倍、n倍,
稀释后两种溶液的pH都变成9,则m_______n (填“>”、“<”或“=”)。
(2)已知水存在如下平衡:H2O+H2O![]() H3O++OH-△H>0,现欲使平衡向右移动,且所得溶液显酸性,选择的下列方法是_______。
H3O++OH-△H>0,现欲使平衡向右移动,且所得溶液显酸性,选择的下列方法是_______。
A.向水中加入NaHSO4固体 B.向水中加NaHCO3固体
C.加热至100℃ [其中c (H+) =1×10-6 mol·L-1] D.向水中加入NH4Cl固体
(3)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)=_______;在pH=3的CH3COOH溶液中,水电离出来的c(H+)=_______。
(4)NH4Cl溶液中离子浓度大小顺序为______________。
(5)物质的量浓度相同的⑥、⑦、⑧、⑨四种稀溶液中,NH4+浓度由大到小的顺序是(填序号)_______。
(6)己知t℃时,Kw=1×10-12,在该温度时将pH=9的NaOH溶液a L与pH=2的H2SO4溶液bL混和(忽略混合后溶液体积的变化),若所得混合溶液的pH=3,则出a∶b=_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,向a L密闭容器中加入1 mol O2和2 mol NO,发生如下反应:O2(g)+2NO(g)![]() 2NO2(g),表明此反应不一定达平衡的是( )
2NO2(g),表明此反应不一定达平衡的是( )
A.容器内O2、NO、NO2的浓度之比为1∶2∶2
B.容器内压强不随时间变化
C.容器内各物质的浓度不随时间变化
D.单位时间内生成1 mol O2,同时生成2 mol NO2
查看答案和解析>>
科目: 来源: 题型:
【题目】水质检验中,测定水的硬度时,用到氨-氯化氨![]() 缓冲溶液,控制溶液在
缓冲溶液,控制溶液在![]() 左右.则关于该缓冲溶液的说法不正确的是
左右.则关于该缓冲溶液的说法不正确的是
A.将缓冲溶液加水稀释时,pH一定会减小
B.将缓冲溶液升温,pH一定没有变化
C.在缓冲溶液中,水的电离受到抑制
D.在缓冲溶液中,一定有![]()
查看答案和解析>>
科目: 来源: 题型:
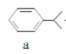
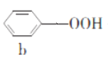
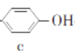
【题目】苯酚和丙酮都是重要的化工原料,工业上可用异丙苯氧化法生产苯酚和丙酮,其反应和工艺流程示意图如下,下列有关说法正确的是
![]()
![]()
 +
+![]()
A.a、b、c均属于芳香烃B.a、d中所有碳原子均处于同一平面上
C.A有9种属于芳香族的同分异构体D.c、d均能发生氧化反应
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)按要求书写
![]() 系统命名是________________________________
系统命名是________________________________
2—甲基—1,3-丁二烯的结构简式 __________________________________
(2)下列各对物质中属于同系物的是___________________,属于同分异构体的是____________属于同位素的是__________,属于同素异形体的是___________
A ![]() C与
C与![]() C B O2与O3
C B O2与O3
C  D
D 
E  与
与
(3)下列属于苯的同系物的是____________________(填字母)。
A  B
B ![]() C
C ![]() D
D 
查看答案和解析>>
科目: 来源: 题型:
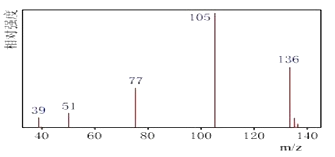
【题目】某有机化合物A经李比希法测得其中含碳为70.6%、含氢为5.9%其余含有氧。现用下列方法测定该有机化合物的相对分子质量和分子结构。
方法一:用质谱法分析得知A的质谱图如图下:
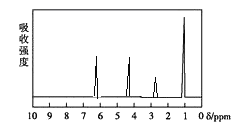
方法二: 核磁共振仪测出A的核磁共振氢谱如图。
方法三: 利用红外光谱仪测得A分子的红外光谱,如下图。
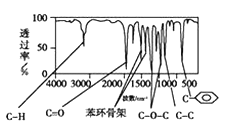
已知:A分子中苯环上只有一个取代基,试回答下列问题。
(1)A分子的相对分子量是_______________。其有____________种化学环境不同的氢原子。
(2)A的分子式为_______________________。
(3)该有机物含有的官能团是______________________。
(4)A的分子中只含一个甲基的直接依据是________________(填序号)。
a.A的相对分子质量 b.A的分子式
c.A的核磁共振氢谱图 d.A分子的红外光谱图
(5)A的结构简式为_______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.现有下列仪器或用品:①铁架台(含铁圈、各式铁夹) ②锥形瓶 ③酸式滴定管和碱式滴定管 ④烧杯 ⑤玻璃棒 ⑥胶头滴管 ⑦天平(含砝码) ⑧滤纸 ⑨量筒 ⑩过滤漏斗;
现有下列药品:(A)NaOH固体 (B)标准NaOH溶液(C)未知浓度盐酸 (D)蒸馏水(E)碳酸钠溶液
根据所做过的学生实验,回答下列问题:
(1)过滤时,应选用的上述仪器是_________________________(填编号)。
(2)配制一定物质的量浓度的NaOH溶液时,还缺少的仪器是__________。
(3)做酸碱中和滴定时,还缺乏的试剂是____________________。
(4)进行中和滴定时,绝不可用将要盛的溶液事先润洗的仪器是下列的______(填编号)。甲.酸式滴定管 乙.碱式滴定管 丙.锥形瓶
(5)用标准的NaOH溶液滴定未知浓度的盐酸,选用酚酞作为指示剂,造成测定结果偏高的原因可能是______________。
A.配制标准溶液的NaOH中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗
D.滴定前有气泡,滴定后气泡消失。
II. 甲醇(CH3OH)是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
反应II:CO(g)+2H2(g)![]() CH3OH(g) ΔH2
CH3OH(g) ΔH2
①反应I的平衡常数表达式为K=________________________
②下表所列数据是反应Ⅱ在不同温度下的化学平衡常数(K)
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断ΔH2______0,ΔS______0 (填“>”、“=”或“<”=)。
③某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为________。
(2)已知在常温常压下,某实验小组依据甲醇燃烧的反应原理,设计如下图所示的电池装置:

①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH =-1275.6 kJ·mol-1
②H2O(g)=H2O(l) ΔH =-44.0 kJ·mol-1
①写出表示甲醇燃烧热的热化学方程式____________________。
②写出上图电池装置中负极反应式:________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com