
科目: 来源: 题型:
【题目】中国科学院上海有机化学研究所有机氟化学重点实验室在寻找新的![]() 反应砌块的过程中,意外发现一种安全、高效合成罕见的硫(Ⅵ)氟类无机化合物
反应砌块的过程中,意外发现一种安全、高效合成罕见的硫(Ⅵ)氟类无机化合物![]() (氟磺酰基叠氮)的方法,该化合物对于一级胺类化合物有极高的重氮转移反应活性和选择性.请回答下列问题:
(氟磺酰基叠氮)的方法,该化合物对于一级胺类化合物有极高的重氮转移反应活性和选择性.请回答下列问题:
(1)基态硫的价电子排布为_________________,氟的最高能级中电子云的形状为_______________.
(2)![]() 中四种元素的第一电离能由大到小的顺序为___________________.
中四种元素的第一电离能由大到小的顺序为___________________.
(3)以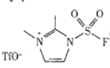 和NaN3为原料在一定条件下可合成
和NaN3为原料在一定条件下可合成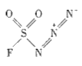 (氟磺酰基叠氮).
(氟磺酰基叠氮).
①NaN3中阴离子的中心氮原子的杂化方式为__________________.
② 中不存在_______________(填字母).
中不存在_______________(填字母).
A.极性键B.非极性键C.离子键D.金属键E.σ键F.π键
(4)H-S-C≡N和H-N=C=S均为叠氮酸(HN3)的等电子体,二者的沸点: H-S-C≡N<H-N=C=S,其原因是_________________,H-S-C≡N、H-N=C=S晶体中,有一种采用分子密堆积,即配位数为12,该物质是_____________________(填结构式).
(5)NaN3晶体的晶胞结构如图所示.
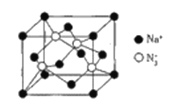
①晶体中,每个Na+周围与它距离最近且相等的Na+共有_____________个
②设阿伏加德罗常数的值为NA,晶胞参数为apm,则NaN3晶体的密度为_____________g·cm-3(列出计算式).
查看答案和解析>>
科目: 来源: 题型:
【题目】磷酸二氢钾(KH2PO4)是一种大型非线性光学晶体,在未来能源领域——“人造太阳”计划中有重要作用.以氯磷灰石(主要成分为Ca5(PO4)3Cl,还含有少量Al2O3、Fe2O3等杂质)为原料制备KH2PO4的一种工艺流程如图所示:
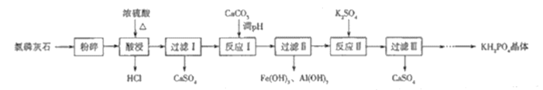
已知:①离子完全沉淀时的pH为Fe3+:3.5,Al3+:5.2.
②Ca3(PO4)2与CaHPO4均难溶于水,Ca(H2PO4)2能溶于水
(1)已知“酸浸”时发生反应的化学方程式为![]() ,该反应体现了浓硫酸的______________________性和___________________性.
,该反应体现了浓硫酸的______________________性和___________________性.
(2)如果将原料改为氟磷灰石,则“酸浸”时不能使用玻璃容器,原因是______________________.
(3)“反应Ⅱ”的化学方程式为________________________________________.
(4)常温下磷酸的电离平衡常数![]() 、
、![]() 、
、![]() ,
,![]() 的电离常数
的电离常数![]() 、
、![]() ,则常温下KH2PO4水溶液显____________________(填“酸性”“碱性”或“中性”);将少量磷酸滴入碳酸钠溶液中反应的离子方程式为______________________________.
,则常温下KH2PO4水溶液显____________________(填“酸性”“碱性”或“中性”);将少量磷酸滴入碳酸钠溶液中反应的离子方程式为______________________________.
(5)KH2PO4也可以通过如图所示装置电解制备:
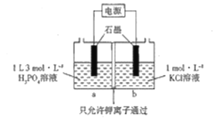
则阳极的电极反应式为___________________.假如通电前a、b两室溶液的质量相等,若有2NA个K+通过交换膜,则两室溶液的质量差为__________________g.
查看答案和解析>>
科目: 来源: 题型:
【题目】新冠肺炎疫情期间,多种含氯消毒剂如84消毒液、Cl2、NaClO2等对病毒均具有很好的消杀作用,其中亚氯酸钠(NaClO2)在工业上常以ClO2气体为原料制备,实验室制备亚氯酸钠的装置如图所示(夹持装置已略)。
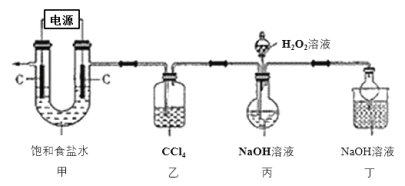
已知:①控制电压电解饱和食盐水可得到ClO2;
②Cl2易溶于CCl4;
③亚氯酸钠在不同温度下的溶解度如下表所示:
温度℃ | 20 | 40 | 60 |
溶解度/g | 6.2 | 23.4 | 48.3 |
回答下列问题:
(1)装置甲中产生ClO2的电极反应式为_____________________。
(2)装置乙中CCl4的作用为________________________________。
(3)装置丙中生成NaClO2的化学方程式为____________________________。
(4)从装置丙反应后的溶液中获得NaClO2晶体的步骤如下:
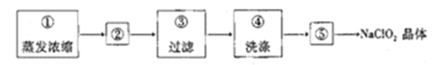
其中步骤①加热到_________________(填现象)时停止加热,步骤②是__________________。
(5)准确称取2.26gNaClO2粗品,加入盛有20.00mL刚煮沸并冷却过的水、足量10%的稀硫酸和30.00mL质量分数为40%的KI溶液(足量)的碘量瓶中,立即密封并摇晃碘量瓶至试样完全反应,再加入淀粉作指示剂用浓度为3.00mol/L的Na2S2O3溶液滴定(已知整个过程中发生的反应依次为![]() +4I-+4H+=2I2+Cl-+2H2O,
+4I-+4H+=2I2+Cl-+2H2O,![]() ),
),
①若三次平行实验测得消耗的Na2S2O3溶液的平均体积为30.00mL,则粗品的纯度为_________________%(保留三位有效数字),
②若使用的水未煮沸,则测定结果会___________________(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】羰基硫(COS)在常温常压下为有臭鸡蛋气味的无色气体,广泛应用于农药、医药和其他化工生产中,存在于煤、石油和天然气中的羰基硫会腐蚀设备、污染环境,更会危害人体健康,工业上处理羰基硫常见的方法有水解反应和氢解反应。
(1)已知羰基硫中所有原子最外层均达到8电子结构,则其结构式为________________。
(2)①已知:H2(g)+COS(g)![]() H2S(g)+CO(g)△H1=+6.2kJ·mol-1;
H2S(g)+CO(g)△H1=+6.2kJ·mol-1;
②H2(g)+CO2(g)![]() H2O(g)+CO(g)△H2=+41.2kJ·mol-1;
H2O(g)+CO(g)△H2=+41.2kJ·mol-1;
则COS水解反应的热化学方程式为H2O(g)+COS(g)=H2S(g)+CO2(g),△H=___________kJ/mol.
②已知:COS水解反应的机理如下,其中吸附在催化剂表面的物种用*标注。
a. 吸附:H2O→H2O*
b. 反应:COS+H2O*→CO2+H2S*
c. 脱附:H2S*→H2S
已知COS水解反应的反应速率由b决定,则a、b、c三步中活化能最大的是__________________。
(3)已知COS氢解反应的热化学方程式为H2(g)+COS(g)![]() H2S(g)+CO(g) △H=+6.2kJ·mol-1,一定温度下,向某恒容密闭容器中充入4molCOS(g)和6molH2(g)发生氢解反应,H2、COS的体积分数
H2S(g)+CO(g) △H=+6.2kJ·mol-1,一定温度下,向某恒容密闭容器中充入4molCOS(g)和6molH2(g)发生氢解反应,H2、COS的体积分数![]() 随时间变化的关系如图所示,
随时间变化的关系如图所示,
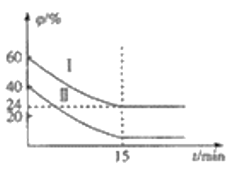
①H2的平衡转化率为_________________,
②该温度下,反应的平衡常数K为__________________,
③其他条件不变,20min时,向该容器中充入2molH2和3molCO,此时v(正)______________v(逆)(填“大于”“小于”或“等于”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知X、Y、Z、W、M均为短周期主族元素,X与W、M形成的化合物XW2、XM4均为重要的溶剂,25℃时,浓度均为0.1moL·L-1的上述元素的最高价氧化物对应的水化物溶液的pH随原子序数的变化如图所示.
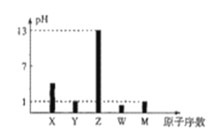
回答下列问题:
(1)M在元素周期表中的位置为___________________.
(2)W可与Z形成化合物Z2W2,写出该物质的电子式:___________________________.
(3)写出一个能说明W与M非金属性强弱的离子方程式:__________________________.
(4)Z的单质可以与X的最高价氧化物反应生成一种盐和黑色固体单质,若每转移1mol电子,恢复至室温时该反应放出QkJ热量,写出该反应的热化学方程式:________________________________________.
(5)M的单质为有毒气体,且在工业上用途广泛,常用Y的简单氢化物检验其运输管道是否漏气,漏气时的现象为产生白烟,该反应中氧化剂与还原剂的物质的量之比为___________________.
查看答案和解析>>
科目: 来源: 题型:
【题目】298K时用0.05mol·L-1氨水滴定20mL0.05mol·L-1的叠氮酸(HN3)溶液,滴定过程中混合溶液的电阻率变化情况如图所示,已知NH3·H2O的电离常数Kb=1.7×10-5,HN3的电离常数Ka=1.9×10-5.下列说法中错误的是
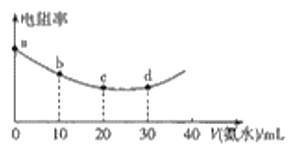
A.电阻率与离子浓度和离子所带电荷有关
B.a、b、c、d四点中,水的电离程度最大的是c
C.c~d之间可能存在:c(N3-)=c(NH4+)>c(H+)=c(OH-)
D.若用0.05mol·L-1HN3溶液滴定20mL0.05mol·L-1氨水,则所得曲线完全相同
查看答案和解析>>
科目: 来源: 题型:
【题目】沼气是重要的生物质能,主要由有机废弃物发酵产生,其成分有CH4、CO2和H2S等,由沼气获得高纯度CH4的工作原理如图所示(交换膜左侧为酸性溶液,右侧为碱性溶液),下列说法中错误的是
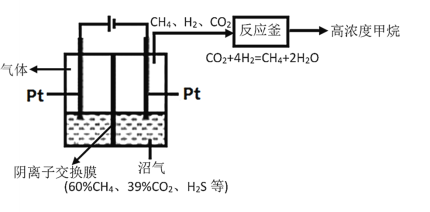
A.对沼气池进行检修时应预先通风并戴防毒面具
B.阴离子应从左侧向右侧迁移
C.在阳极上可能发生反应:HS--2e-=S↓+H+
D.一定条件下反应釜中的反应能自发进行,主要原因是该反应放热
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、M、N是原子序数依次增大的五种短周期主族元索,它们能形成一种有机酸(结构如图),五种元素原子的最外层电子数之和为24,Z和N同主族,M是非金属性最强的元素,下列说法错误的是
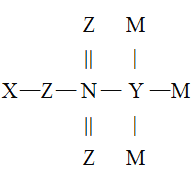
A.最高正化合价:N>Y>X
B.Z、N可分别与X形成等电子数的化合物
C.原子半径:N>Z>Y>M>X
D.Y和N均存在某种含氧酸能使酸性KMnO4溶液褪色
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组设计如下两个实验证明:①氧化性:Fe3+>I2,②反应2Fe3++2I-=2Fe2++I2为可逆反应,下列说法中错误的是
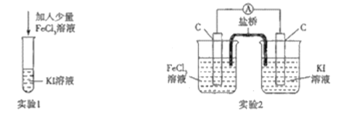
A.实验1试管中加入淀粉后溶液变蓝,该条件下氧化性:Fe3+>I2
B.实验2中最后电流表指针不再偏转可证明上述反应为可逆反应
C.实验1反应结束后,向试管中加入KSCN能判断该反应是否为可逆反应
D.实验2电流表指针不再偏转时,向右侧烧杯中加入单质碘可判断该反应是否为可逆反应
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质分离和提纯的方法错误的是
A.除去MgCl2溶液中的少量FeCl3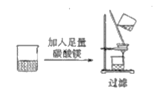
B.分离碘粉和铁粉的混合物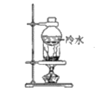
C.除去NaCl中的少量KNO3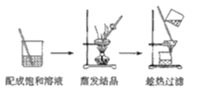
D.分离砂子、鸡蛋清和葡萄糖溶液的混合物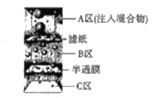
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com