
科目: 来源: 题型:
【题目】科学研究证明:核外电子的能量不仅与电子所处的电子层、能级有关,还与核外电子的数目及核电荷数有关。氩原子与硫离子的核外电子排布相同,都是![]() 。下列说法正确的是( )
。下列说法正确的是( )
A.两粒子的1s能级上电子的能量相同
B.两粒子的3p能级上的电子离核的距离相同
C.两粒子的电子发生跃迁时,产生的光谱不同
D.两粒子最外层都达8电子稳定结构,化学性质相同
查看答案和解析>>
科目: 来源: 题型:
【题目】第3周期某元素的原子,其最外层3p轨道上有一个未成对电子,则关于该元素的描述正确的是( )
A.该元素最高价氧化物的水化物肯定是一种强酸
B.该元素单质可能是一种黄绿色的气体
C.该元素最高价氧化物的水化物肯定是一种强碱,只能与酸反应
D.该元素的原子半径在同周期中肯定是最小的![]() 稀有气体元素除外
稀有气体元素除外![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】我国西昌卫星发射中心用“长征三号丙”运载火箭成功发射嫦娥二号探月卫星,火箭的燃料之一是铝粉与高氯酸铵(NH4ClO4)的固体混合物,点燃时,铝粉被氧化放热引发高氯酸铵反应:2NH4ClO4=N2↑+4H2O+Cl2↑+2O2↑,反应放出大量的热。
(1)该反应中被氧化的元素是_____________。
(2)对该反应的反应类型判断正确的是_____________。
A.氧化还原反应B.复分解反应C.置换反应D.分解反应
(3)该反应中若生成1moLCl2,则电子转移数为_____________个。
查看答案和解析>>
科目: 来源: 题型:
【题目】将一定量的铁粉投入FeCl3溶液中,两者恰好完全反应,完成下列问题。
(1)写出该反应的离子方程式并标出电子转移的方向和数目__________________。
(2)该反应中氧化产物和还原产物的物质的量之比为____________。
(3)若反应过程中转移了0.2mol电子,则溶解消耗的铁的质量为___________。
(4)如何检验某未知溶液中是否含有Fe3+________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式书写正确的是
A.用FeCl3溶液腐蚀印刷电路板上铜箔:2Fe3++Cu=2Fe2++Cu2+
B.Fe与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
C.氢氧化钡溶液与硫酸反应:Ba2++![]() +OH-+H+=H2O+BaSO4↓
+OH-+H+=H2O+BaSO4↓
D.向小苏打溶液中滴入醋酸:![]() +2CH3COOH=CO2↑+H2O+2CH3COO-
+2CH3COOH=CO2↑+H2O+2CH3COO-
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式不正确的是
A.FeCl2溶液和Cl2反应:2Fe2++Cl2=2Fe3++2Cl-
B.钠与水反应:Na+H2O=Na++OH-+H2↑
C.Na2CO3溶液与足量盐酸反应:![]() +2H+=CO2↑+H2O
+2H+=CO2↑+H2O
D.NaHCO3溶液与NaOH溶液:![]() +OH-=
+OH-=![]() -+H2O
-+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】利用硫酸渣(主要含Fe2O3、FeO,杂质为Al2O3和SiO2等)生产铁基颜料铁黄(FeOOH)的制备流程如下:
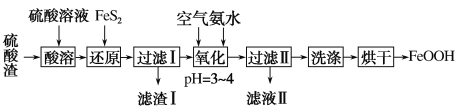
(1)“酸溶”时,Fe2O3与硫酸反应的离子方程式为___________________。
(2)滤渣I的主要成分是FeS2、S和___________(填化学式);Fe3+被FeS2还原的离子方程式为_______________。
(3)“氧化”中,生成FeOOH的离子方程式为_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中由于哑铃形的C![]() 存在,使晶胞沿一个方向拉长。下列关于CaC2晶体的说法中正确的是:
存在,使晶胞沿一个方向拉长。下列关于CaC2晶体的说法中正确的是:
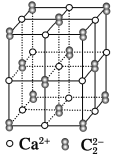
A.1个Ca2+周围距离最近且等距离的C![]() 数目为6
数目为6
B.该晶体中的阴离子与F2是等电子体
C.6.4 g CaC2晶体中含阴离子0.1 mol
D.与每个Ca2+距离相等且最近的Ca2+共有12个
查看答案和解析>>
科目: 来源: 题型:
【题目】以NA表示阿伏加德罗常数的值,下列说法错误的是
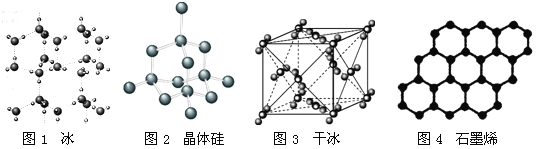
A. 18g冰(图1)中含O—H键数目为2NA
B. 28g晶体硅(图2)中含有Si—Si键数目为2NA
C. 44g干冰(图3)中含有NA个晶胞结构单元
D. 石墨烯(图4)是碳原子单层片状新材料,12g石墨烯中含C—C键数目为1.5NA
查看答案和解析>>
科目: 来源: 题型:
【题目】钛及其化合物被广泛应用于飞机、火箭、卫星、舰艇、医疗以及石油化工等领域。
(1)Ti的基态原子的电子排布式为________。
(2)已知TiC在碳化物中硬度最大,工业上一般在真空和高温(>1800℃)条件下用C还原TiO2制取TiC: TiO2+3C![]() TiC+2CO↑。该反应中涉及的元素按电负性由大到小的顺序排列为_____________;根据所给信息,可知TiC是________晶体。
TiC+2CO↑。该反应中涉及的元素按电负性由大到小的顺序排列为_____________;根据所给信息,可知TiC是________晶体。
(3)钛的化合物TiCl4,熔点为-24℃,沸点为136.4℃,常温下是无色液体,可溶于甲苯和氯代烃。
①固态TiCl4属于________晶体,其空间构型为正四面体,则钛原子的杂化方式为__________。
②TiCl4遇水发生剧烈的非氧化还原反应,生成两种酸,反应的化学方程式为_________
③用锌还原TiCl4的盐酸溶液,经后续处理可制得绿色的配合物[TiCl(H2O)5]Cl2·H2O.该配合物中含有化学键的类型有_________、__________。
(4)钛的一种氧化物是优良的颜料,该氧化物的晶胞如右图所示:

该氧化物的化学式为________;在晶胞中Ti原子的配位数为_______,若晶胞边长为a nm,NA为阿伏伽德罗常数的数值,列式表示氧化钛晶体的密度:___________g/cm3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com