|
试题详情
Ⅱ、摩尔质量M(或平均摩尔质量 ) ) 试题详情
M=22.4L?mol-1×ρ, 试题详情
 =M(A)ф(A)+M(B)ф(B)+???
ф为体积分数。 =M(A)ф(A)+M(B)ф(B)+???
ф为体积分数。
试题详情
试题详情
一、质量守恒定律的直接应用 [例1]有一在空气里暴露过的KOH固体样品,经分析其含水7.65%,含K2CO34.32%,其余是KOH。若将ag样品放入bmL1mol/L的盐酸中,使其充分作用后,残酸用25.25mLcmol/L的KOH溶液恰好中和完全。蒸发所得溶液,得到固体质量的表达式中(单位g) A. 只含有a B. 只含有b C. 必含有b D. 一定有a、b和c 试题详情
[解析]本题如使用Cl原子守恒的方法可大大简化解题步骤。由题意,反应后溶液为KCl溶液,其中的Cl-来自盐酸,所以所得KCl固体的物质的量与HCl的物质的量相等,即为0.001bmol,质量为0.0745bg。如果解题时使用ag这个数据,也能获得答案,此时答案中也会含有b,请读者自行解答。 本题正确答案为C。 试题详情
[例2]在一定条件下,16gA和22gB恰好反应生成C和4.5gD。在相同条件下,8gA和15gB反应可生成D和0.125molC。从上述事实可推知C的式量为____________。 试题详情
[解析]根据质量守恒定律,当16gA与22gB恰好反应生成4.5gD的同时,生成C的质量应为16+22-4.5=33.5g,当8gA和15gB反应时,根据判断B是过量的,A与C的质量关系应是16:33.5=8:x,x=16.75g,MC=16.75g/0.125mol=134g/mol,即C的式量为134。 [例3]下列说法正确的是(NA表示阿伏加德罗常数) 试题详情
二、阿伏加德罗常数的直接应用 A. 标准状况下,以任意比例混合的甲烷和丙烷混合物22.4L,则所含有的分子数为NA 试题详情
B. 标准状况下,1L辛烷完全燃烧后,所生成气态产物的分子数为 C. 常温常压下,活泼金属从盐酸中置换出1molH2时发生转移的电子数为2NA D. 常温常压下,1mol氦气含有的核外电子数为4NA 试题详情
[解析]阿伏加德罗定律所述的气体包括混合气体。标准状况下,22.4L混合气体所含有的分子数为NA,所以选项A正确。标准状况下,辛烷是液体,不能使用标准状况下气体的摩尔体积22.4L/mol这一量,所以1L辛烷的物质的量不是1/22.4mol,选项B错误。每生成1molH2时必有2molH+获得2mol电子,即转移电子数为2NA,选项C正确。1个氦原子核外有4个电子,氦气是单原子分子,所以1mol氦气含有4mol电子,这与外界温度和压强无关,所以选项D正确。本题正确答案为AC。 试题详情
三、阿伏加德罗定律与化学方程式计算的综合应用 [例4]在一定条件下,有aLO2和O3的混合气体,当其中的O3全部转化为O2时,体积变为1.2aL,求原混合气中O2和O3的质量百分含量。 [解析]由阿伏加德罗定律,结合化学方程式的意义可知,化学方程式中气体化学式的系数比等于其体积比,所以此题实际上用阿伏加德罗定律的应用题。 设混合气体中O3占xL,则O2为(a-x)L 2O3
==== 3O2
2L 3L
xL (3/2)xL 试题详情
(3/2)x+(a-x)=1.2a,解得x=0.4a 试题详情
根据阿伏加德罗定律:n(O3):n(O2)=V(O3):V(O2)=0.4a:0.6a=2:3 试题详情
w(O2)= =50% , w(O2)=1-50%=50%。 =50% , w(O2)=1-50%=50%。 [例5]在某温度时,一定量的元素A的氢化物AH3在一定体积密闭容器中可完全分解成两种气态单质,此时压强增加了75%。则A单质的一个分子中有_______个A原子,AH3分解反应的化学方程式为__________________________________________。 试题详情
四、阿伏加德罗定律与质量守恒定律的综合应用 [解析]由阿伏加德罗定律的推论:相同温度和压强时,p1/p2=N1/N2得反应前后气体的分子数之比为1:1.75=4:7,可理解为反应式左边气体和反应式右边气体系数之和的比为4:7,再按氢原子守恒不妨先将反应式写为4AH3==A( )+6H2,再由A原子守恒得A右下角的数字为4。 本题答案为:4,4AH3==A4+6H2。 五、阿伏加德罗定律与化学平衡的综合应用 试题详情
[例6]1体积SO2和3体积空气混合后,在450℃以上通过V2O5催化剂发生如下反应:2SO2(气)+O2(气) 2SO3(气),若在同温同压下测得反应前后混合气体的密度比为0.9:1。则反应掉的SO2是原有SO2的___________%。 2SO3(气),若在同温同压下测得反应前后混合气体的密度比为0.9:1。则反应掉的SO2是原有SO2的___________%。 试题详情
[解析]由阿伏加德罗定律的推论可知: ,V2=0.9×(3+1)=3.6体积。 ,V2=0.9×(3+1)=3.6体积。 设参加反应的SO2为x体积,由差量法 试题详情
2SO2
+ O2 2SO3 ΔV 2SO3 ΔV
2
3-2=1 试题详情
试题详情
2:1=x:0.4 解得x=0.8体积,所以反应掉的体积是原有SO2的 。 。 六、阿伏加德罗定律与热化学方程式的综合应用 试题详情
[例7] 将4g甲烷和适量氧气混合后通入一密闭容器中,点燃使之恰好完全反应,待恢复到原温度后,测得反应前后压强分别为3.03×105Pa和1.01×105Pa,同时又测得反应共放出222.5kJ热量。试根据上述实验数据,写出该反应的热化学方程式。 试题详情
[解析]书写热化学方程式有两个注意事项:一是必须标明各物质的聚集状态,二是注明反应过程中的热效应(放热用“+”,吸热用“-”)。要写本题的热化学方程式,需要解决两个问题,一是水的状态,二是反应过程中对应的热效应。由阿伏加德罗定律的推论可知: ,根据甲烷燃烧反应的化学方程式可知,水在该状态下是液体(想一想,如为气体则反应前后的压强比应为多少?),因4g甲烷燃烧时放出222.5kJ热量,则1mol甲烷燃烧时放出的热量为 ,根据甲烷燃烧反应的化学方程式可知,水在该状态下是液体(想一想,如为气体则反应前后的压强比应为多少?),因4g甲烷燃烧时放出222.5kJ热量,则1mol甲烷燃烧时放出的热量为 。 。 本题答案为:CH4(气)+2O2(气)==CO2(气)+2H2O(液)+890kJ 4.实战演练 试题详情
1.根据化学反应A+B==C+D中,某学生作了如下四种叙述:①若mgA与B充分反应后生成ngC和wgD,则参加反应的B的质量为(m+n-w)g;②若mgA和ngB完全反应,生成的C和D的总质量是(m+n)g;③若取A、B各mg,则反应生成C和D的质量总和不一定是2mg;④反应物A、B的质量比一定等于C、D的质量比
( ) A. ①②③
B. ②③④
C. ①④
D. ②③ 试题详情
2.现有A、B、C三种化合物,各取40g相混合,完全反应后,得B18g,C49g,还有D生成。已知D的式量为106。现将22gA和11gB反应,能生成D
( ) 试题详情
A.
1mol
B. 0.5mol
C. 0.275mol
D. 0.25mol 试题详情
3.质量为25.4g的KOH和KHCO3混合物先在250℃加热,冷却后发现混合物质量损失4.9g,则原混合物中KOH和KHCO3的组成为
( ) A. 物质的量 KOH=KHCO3
B. 物质的量 KOH>KHCO3 C. 物质的量 KOH<KHCO3
D. KOH< KHCO3的任意比 试题详情
4.在反应X+2Y==R+M中,已知R和M的摩尔质量之比为22:9,当1.6gX与Y完全反应后,生成4.4gR,则此反应中Y和M的质量之比为
( ) A.
16:9
B. 32:9
C. 23:9
D. 46:9 试题详情
5.设NA表示阿伏加德罗常数,下列说法正确的是
( ) 试题详情
A. 1L1mol/L的Na2CO3溶液中含CO32- 0.1NA 试题详情
试题详情
C. 常温下100mL0.1mol/L醋酸溶液中含醋酸分子0.01NA 试题详情
D.
0.1molNa2O2与足量水反应转移电子数0.1NA 试题详情
6.设阿伏加德罗常数为NA,标准状况下,某种O2和N2的混合气体mg含有b个分子,则ng该混合气体在相同条件下所占的体积(L)应是
( ) 试题详情
试题详情
7.nmolN2和nmol14CO相比较,下列叙述中正确的是
( ) A. 在同温同压下体积相等
B. 在同温同压下密度相等 C. 在标准状况下质量相等
D. 分子数相等 试题详情
8.常温常压下,某容器真空时质量为201.0g,当它盛满甲烷时质量为203.4g,而盛满某气体Y时质量为205.5g,则Y气体可能是
( ) A. 氧气
B. 氮气
C. 乙烷
D. 一氧化氮 试题详情
9.同温同压下,1体积氮气和3体积氢气化合生成2体积氨气。已知氮气和氢气都由最简单分子构成,推断它们都是双原子分子和氨的化学式的主要依据是
( ) ①阿伏加德罗定律;②质量守恒定律;③原子或分子数只能为整数;④化合价规则 A. ①③
B. ①②③
C. ①②④
D. ①②③④ 试题详情
10.将空气与CO2按5:1体积比混合,跟足量的赤热的焦炭充分反应,若反应前后温度相同,则在所得气体中,CO的体积百分含量为(假设空气中氮、氧体积比为4:1,其它成分可忽略不计)
( ) A.
29%
B. 43%
C. 50%
D. 100% 试题详情
11.在一密闭容器中盛有H2、O2、Cl2组成的混合气体,通过电火花引爆后,三种气体恰好完全反应。经充分反应后,测得所得溶液的质量分数为33.4%,则原混合气中三种气体的体积比是________。 试题详情
12.已知A、B两种气体在一定条件下可发生反应:2A+B==C+3D+4E。现将相对分子质量为M的A气体mg和足量B气体充入一密闭容器中恰好完全反应后,有少量液滴生成;在相同温度下测得反应前后压强分别为6.06×105Pa和1.01×105Pa,又测得反应共放出QkJ热量。试根据上述实验数据写出该反应的热化学方程式。 ________________________________________________________________ 试题详情
13.化合物A 是一种不稳定的物质,它的分子组成可用OxFy表示。10mLA气体能分解生成15mLO2和10mLF2(同温同压)。 ⑴A的化学式是___________,推断理由是________________________________________ ____________________________________________。 ⑵已知A分子中x个氧原子呈…O―O―O…链状排列,则A分子的电子式是______________,A分子的结构式是______________。 试题详情
14.A、B两种金属元素的相对原子质量之比是8:9。将两种金属单质按物质的量之比为3:2组成1.26g混合物。将此混合物与足量稀硫酸溶液反应,放出1.344L(标准状况)氢气。若这两种金属单质在反应中生成氢气的体积相等,则A的摩尔质量是__________,B的摩尔质量是__________。 试题详情
15.氢气和氧气的混合气体,在120℃和一定压强下体积为aL,点燃后发生反应,待气体恢复到原来的温度和压强时测得其体积为bL,原混合气体中氢气和氧气各是多少升? 试题详情
16.测定人呼出气体中CO2的含量时,将100mL呼出的气体通入50.0mLBa(OH)2溶液中,使其完全吸收,过滤后取20.0mL澄清溶液,用0.100mol/L盐酸滴定,当耗掉20.4mL盐酸时,恰好完全反应。另取20.0mL原Ba(OH)2溶液,用同种盐酸滴定耗去36.4mL盐酸时,恰好完全反应。试计算人呼出气体中CO2的体积分数(气体体积均在标准状况下测定)。 试题详情
 17.用电解法根据电极上析出物质的质量来验证阿 17.用电解法根据电极上析出物质的质量来验证阿
伏加德罗常数值,其实验方案的要点为: ①用直流电电解氯化铜溶液,所用仪器如图1-1 所示。 ②在电流强度为IA(安),通电时间为ts后,精 确测得某电极上析出的铜的质量为mg。
图1-1 试回答: ⑴连接这些仪器的正确顺序为(用图中标注仪器接线柱的英文字母表示,下同):E接_____, C接______,______接F。 实验线路中的电流方向为_____→_____→_____→C→_____→______。 ⑵写出B电极上发生反应的离子方程式:_______________________________________; G试管中淀粉KI溶液变化的现象为______________________________________;相应的离 子方程式是________________________________________。 ⑶为精确测定电极上析出铜的质量,所必需的实验步骤的先后顺序应是____________。 ①称量电解前电极质量;②刮下电解后电极上的铜并清洗;③用蒸馏水清洗电解后电极; ④低温烘干电极后称量;⑤低温烘干刮下的铜后称量;⑥再次低温烘干后称量至恒重。 试题详情
⑷已知电子的电量为1.6×10-19C。试列出阿伏加德罗常数的计算表达式: NA=_______________。 试题详情
18.将标况下1L由CO和某气态单烯烃的混合气体与9LO2混合。点燃、充分燃烧后在压强不变、温度为409.5K时,测得气体的总体积为15L。试求该烯烃的分子式以及它在混合气体中占的体积分数。 答案 试题详情
1、D 2、D 3、C 4、C 5、D 6、A 7、AD 8、CD 9、B 10、C 试题详情
试题详情
12、2A(气)+B(气)==C(气)+3D(液)+4E(气)+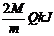 试题详情
 13、⑴O3F2;质量守恒定律和阿伏加德罗定律 13、⑴O3F2;质量守恒定律和阿伏加德罗定律
⑵
试题详情
试题详情
15、①若原混合气体中V(H2):V(O2)≥2时,V(O2)=(a-b)L,V(H2)=bL;②若原混合气体中,V(H2):V(O2)<2时,V(H2)=2(a-b)L,V(O2)=(2b-a)L 试题详情
试题详情
17、⑴D;A;B;F→B→A→C→D→E ⑵2Cl--2e==Cl2↑;变蓝色 Cl2+2I-==2Cl‑+I2 ⑶①③④⑥ 试题详情
⑷ 试题详情
试题详情
| 
 ①、定义:表示含有一定数目粒子的集体。
①、定义:表示含有一定数目粒子的集体。 物质的量 ③、单位:摩尔、摩、符号mol
物质的量 ③、单位:摩尔、摩、符号mol ①、定义:1mol任何粒子的粒子数叫阿伏加德罗常数。
①、定义:1mol任何粒子的粒子数叫阿伏加德罗常数。 ①、定义:单位物质的量气体所占的体积叫~
①、定义:单位物质的量气体所占的体积叫~ 基本概念 气体摩尔体积:②、符号:Vm
基本概念 气体摩尔体积:②、符号:Vm ①、定义:单位物质的量物质所具有的质量叫~
①、定义:单位物质的量物质所具有的质量叫~
 ①、定义:单位体积溶液中所含溶质B的物质的量来表示溶液组成的物理量叫溶质B的物质的量浓度。
①、定义:单位体积溶液中所含溶质B的物质的量来表示溶液组成的物理量叫溶质B的物质的量浓度。 ①、定律:在相同温度和压强下,相同体积的作何气体都含有相同数目的分子。
①、定律:在相同温度和压强下,相同体积的作何气体都含有相同数目的分子。 同温同压下:
同温同压下: