
科目:gzhx 来源: 题型:
| A、增大反应物浓度,单位体积内活化分子数增多,有效碰撞几率增加 | B、有气体参加的化学反应,若缩小反应容器的体积,主要增大了活化分子的百分数 | C、升高温度,主要增加了反应物分子中活化分子数 | D、加入催化剂后,活化分子数增大,活化分子百分数也增大 |
科目:gzhx 来源: 题型:
| A、由单质A转化为单质B,△H=+119kJ/mol,可知单质A比单质B稳定 | B、灼热的碳与CO2反应既是氧化还原反应,又是生成物总能量高于反应物总能量的反应 | C、决定化学反应速率的根本因素是参加反应的各物质的结构和性质 | D、对于一个可逆反应(△H<0)达到平衡后,升高温度可以增加活化分子的百分数,提高有效碰撞的次数,使V正增大的倍数大于V逆增大的倍数,从而使化学反应平衡逆向移动 |
科目:gzhx 来源: 题型:
| A、热化学方程式中,如果没有注明温度和压强,则表示在标准状况下测得的数据 | B、物质发生化学变化时都伴随着能量变化 | C、活化分子之间发生的碰撞一定为有效碰撞 | D、对有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大 |
科目:gzhx 来源: 题型:
| A、活化分子之间的碰撞不一定都是有效碰撞 | B、升高温度,可使单位体积内活化分子增多,反应速率加快 | C、对于有气体参加的反应增大压强,可使单位体积内活化分子百分数增加,反应速率加快 | D、催化剂能降低反应的活化能,使单位体积内活化分子百分数大大增加 |
科目:gzhx 来源: 题型:
| A、燃烧热随化学方程式前的化学计量数的改变而改变 | B、2O3(g)=3O2(g)△H=-a kJ•mol-1能自发进行 | C、酸碱中和反应放出的热量是中和热 | D、催化剂不影响反应活化能但能增大单位体积内活化分子数,从而增大反应速率 |
科目:gzhx 来源: 题型:
| A、升高温度,有效碰撞次数增加 | B、发生有效碰撞时,不一定发生化学反应 | C、活化分子之间发生的碰撞一定为有效碰撞 | D、加入催化剂,分子能量不变,有效碰撞次数不变 |
科目:gzhx 来源: 题型:
| A、①③⑤ | B、②④⑥ | C、①④⑥ | D、②③⑤ |
科目:gzhx 来源: 题型:
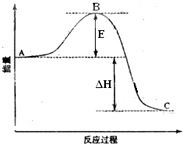 2SO2(g)+O2(g)⇌2SO3(g)反应过程的能量变化如图所示.
2SO2(g)+O2(g)⇌2SO3(g)反应过程的能量变化如图所示.