
科目:gzhx 来源:2012-2013学年江西省南昌市第二中学高二第一次月考化学试卷(带解析) 题型:填空题
(本题共14分)恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示。请回答下列问题: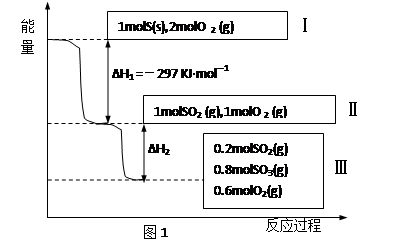
(1)写出能表示硫的燃烧热的热化学方程式: 。
(2)已知在450℃并有催化剂存在下:2 SO2 (g)+O2(g)  2SO3(g) △H = -196.6 KJ·mol-1,
2SO3(g) △H = -196.6 KJ·mol-1,
①该热化学反应方程式的意义是 。
②图1中的ΔH2 = KJ·mol-1
③恒温恒容时,1molSO2和2molO 2充分反应,放出热量的数值比∣ΔH2 ∣ (填“大”“小”或“相等”)
④)恒容条件下,下列措施中能使n(SO3)/ n(SO2 )增大的有 。
a.升高温度 b.充入He气
c.再充入1molSO2 (g)和1molO 2 (g) d.使用催化剂
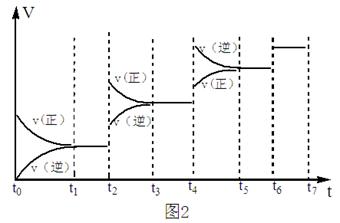
(3) 某SO2(g)和O2(g)体系,时间t1达到平衡后,改变某一外界条件,反应速率 与时间t的关系如图2所示,若不改变SO2 (g)和O 2 (g)的量,则:
与时间t的关系如图2所示,若不改变SO2 (g)和O 2 (g)的量,则:
①图中t4时引起平衡移动的条件可能是 ;
②图中表示平衡混合物中SO3的含量最高的一段时间是____________。
| A.t1~t2 | B.t3~t4 | C.t5~t6 | D.t7~t8 |
科目:gzhx 来源:2014届江西省南昌市高二第一次月考化学试卷(解析版) 题型:填空题
(本题共14分)恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示。请回答下列问题:


(1)写出能表示硫的燃烧热的热化学方程式: 。
(2)已知在450℃并有催化剂存在下:2 SO2 (g)+O2(g)
 2SO3(g)
△H = -196.6 KJ·mol- 1,
2SO3(g)
△H = -196.6 KJ·mol- 1,
①该热化学反应方程式的意义是 。
②图1中的ΔH2 = KJ·mol-1
③恒温恒容时,1molSO2和2molO 2 充分反应,放出热量的数值比∣ΔH2 ∣ (填“大”“小”或“相等”)
④)恒容条件下,下列措施中能使n(SO3)/ n(SO2 )增大的有 。
a.升高温度 b.充入He气
c.再充入1molSO2 (g)和1molO 2 (g) d.使用催化剂
(3) 某SO2(g)和O2(g)体系,时间t1达到平衡后,改变某一外界条件,反应速率 与时间t的关系如图2所示,若不改变SO2 (g)和O 2 (g)的量,则:
与时间t的关系如图2所示,若不改变SO2 (g)和O 2 (g)的量,则:
①图中t4时引起平衡移动的条件可能是 ;
②图中表示平衡混合物中SO3的含量最高的一段时间是____________。
A、t1~t2 B、t3~t4 C、t5~t6 D、t7~t8
科目:gzhx 来源:河北省张家口市涿鹿中学2010-2011学年高二上学期第一次月考文科化学试题 题型:013
|
已知在450℃时,反应H2(g)+I2(g) | |
| [ ] | |
A. |
50 |
B. |
0.02 |
C. |
100 |
D. |
无法确定 |
科目:gzhx 来源: 题型:
 归纳整理是科学学习的重要方法之一.在学习了氧族元素的各种性质后,可归纳整理出如下表所示的表格(部分).
归纳整理是科学学习的重要方法之一.在学习了氧族元素的各种性质后,可归纳整理出如下表所示的表格(部分).| 性质\元素 | 8O | 16S | 34Se | 52Te |
| 单质熔点(℃) | -218.4 | 113 | 217 | 450 |
| 单质沸点(℃) | -183 | 444.6 | 685 | 1390 |
| 主要化合价 | -2 | -2,+4,+6 | -2,+4,+6 | |
| 原子半径 | 逐渐增大 | |||
| 单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
科目:gzhx 来源: 题型:

图1-13
请填写下列空白:
(1)E物质的分子式为_________________。
(2)当Y是__________(填名称)时,则D和H溶液中溶质(填酸、碱、盐、氧化物)属于____________类。
(3)若0.1 mol/L的H溶液,测其pH=1,使H和E按物质的量之比为1∶2的比例混合后,加入水配制V mL溶液,其pH为8.5,则溶液中离子浓度由大到小的顺序为______________。
(4)若D与(3)中的H属于同类物质,将0.15 mol/L的D溶液与pH=13的氢氧化钠溶液等体积混合,混合后溶液的pH为__________________。
(5)从影响反应速率和化学平衡的因素分析,由B生成C的反应为放热反应,其实验数据如下:
不同条件下B的转化率
| 1大气压 | 5大气压 | 10大气压 | 50大气压 | 100大气压 |
97.5 | 98.9 | 99.2 | 99.6 | 99.7 | |
85.7 | 92.9 | 94.9 | 97.7 | 98.3 |
工业生产中应选用的反应条件是__________________,原因是_________________________。
科目:gzhx 来源: 题型:
在2L密闭容器中,合成氨反应N2(g)+3H2(g)![]() 2NH3(g)达到平衡。请回答下列问题:
2NH3(g)达到平衡。请回答下列问题:
(1) 已知:450℃时NH3的浓度大于550℃时,则正反应是______ __热反应;
(2) 反应进程中:0~2s内N2的物质的量由2mol变为1mol,则υ(H2)=___________;
(3) 能说明该反应已经达到平衡状态的是_________ __;
A.c(N2)=c(H2)=c (NH3) B.容器内压强保持不变
C.υ(N2)=3υ(H2) D.容器内的密度保持不变
(4) 可使该反应的反应速率增大,且平衡向正反应方向移动的措施是__________。
A.及时分离出NH3气体 B.适当升高温度
C. 增大压强 D.选择高效的催化剂
科目:gzhx 来源:2012届上海市闵行区高三上学期期末质量抽测化学试卷 题型:填空题
下图是煤化工产业链的一部分,试运用所学知识,解决下列问题: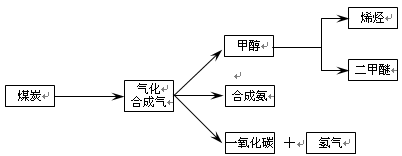
(1)已知该产业链中某反应的平衡表达式为:K=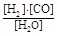
它所对应反应的化学方程式为 。
已知在一定温度下,在同一平衡体系中各反应的平衡常数如下:
C(s)+CO2(g) 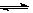 2CO(g),K1
2CO(g),K1
CO(g)+H2O(g) 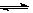 H2(g)+CO2(g),K2
H2(g)+CO2(g),K2
C(s)+H2O(g) 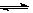 CO(g)+H2(g),K3
CO(g)+H2(g),K3
则K1、K2、K3之间的关系为 。
(2)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:CO(g)+H2O(g) H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
 2NO2(g);△H=Q(Q>0),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 。
2NO2(g);△H=Q(Q>0),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 。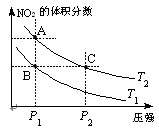
 2N2(g) + 3H2O(g)
2N2(g) + 3H2O(g)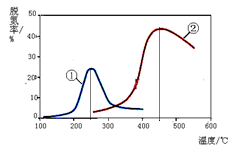
 以下说法正确的是(注:脱氮率即氮氧化物转化率)
以下说法正确的是(注:脱氮率即氮氧化物转化率)科目:gzhx 来源: 题型:阅读理解
下图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
(1)已知该产业链中某反应的平衡表达式为:K=
它所对应反应的化学方程式为 。
已知在一定温度下,在同一平衡体系中各反应的平衡常数如下:
C(s)+CO2(g) 2CO(g),K1
CO(g)+H2O(g) H2(g)+CO2(g),K2
C(s)+H2O(g) CO(g)+H2(g),K3
则K1、K2、K3之间的关系为 。
(2)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:CO(g)+H2O(g)H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
该反应的逆反应方向是 反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,在该条件下,反应达到平衡时CO的转化率为 。
(3)对于反应N2O4(g)2NO2(g)-Q(Q>0),在温度
为T1、T2时,平衡体系中NO2的体积分数随压强变化
曲线如图所示。下列说法正确的是 。
A.两种不同的温度比较:T1 > T2
B.A、C两点的反应速率:A<C
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法实现
(4)如右图,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率,反应原理为:NO(g) + NO2(g) + 2NH3(g) 2N2(g) + 3H2O(g)
以下说法正确的是(注:脱氮率即氮氧化物转化率)
A.上述反应的正反应为吸热反应
B.相同条件下,改变压强对脱氮率没有影响
C.曲线①、②最高点表示此时平衡转化率最高
D.催化剂①、②分别适合于250℃和450℃左右脱氮
科目:gzhx 来源: 题型:
在2L密闭容器中,合成氨反应N2(g)+3H2(g)![]() 2NH3(g)达到平衡。请回答下列问题:
2NH3(g)达到平衡。请回答下列问题:
(1) 已知:450℃时NH3的浓度大于550℃时,则正反应是______ __热反应;
(2) 反应进程中:0~2s内N2的物质的量由2mol变为1mol,则υ(H2)=___________;
(3) 能说明该反应已经达到平衡状态的是_________ __;
A.c(N2)=c(H2)=c (NH3) B.容器内压强保持不变
C.υ(N2)=3υ(H2) D.容器内的密度保持不变
(4) 可使该反应的反应速率增大,且平衡向正反应方向移动的措施是__________。
A.及时分离出NH3气体 B.适当升高温度
C. 增大压强 D.选择高效的催化剂
科目:gzhx 来源:2011-2012学年上海市闵行区高三上学期期末质量抽测化学试卷 题型:填空题
下图是煤化工产业链的一部分,试运用所学知识,解决下列问题:

(1)已知该产业链中某反应的平衡表达式为:K=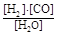
它所对应反应的化学方程式为 。
已知在一定温度下,在同一平衡体系中各反应的平衡常数如下:
C(s)+CO2(g)  2CO(g),K1
2CO(g),K1
CO(g)+H2O(g)  H2(g)+CO2(g),K2
H2(g)+CO2(g),K2
C(s)+H2O(g)  CO(g)+H2(g),K3
CO(g)+H2(g),K3
则K1、K2、K3之间的关系为 。
(2)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:CO(g)+H2O(g) H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
|
温度/℃ |
400 |
500 |
800 |
|
平衡常数K |
9.94 |
9 |
1 |
该反应的逆反应方向是 反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,在该条件下,反应达到平衡时CO的转化率为 。
(3)对于反应N2O4(g) 2NO2(g)-Q(Q>0),在温度
2NO2(g)-Q(Q>0),在温度
为T1、T2时,平衡体系中NO2的体积分数随压强变化
曲线如图所示。下列说法正确的是 。

A.两种不同的温度比较:T1 > T2
B.A、C两点的反应速率:A<C
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法实现
(4)如右图,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率,反应原理为:NO(g) + NO2(g) + 2NH3(g)  2N2(g) + 3H2O(g)
2N2(g) + 3H2O(g)

以下说法正确的是(注:脱氮率即氮氧化物转化率)
A.上述反应的正反应为吸热反应
B.相同条件下,改变压强对脱氮率没有影响
C.曲线①、②最高点表示此时平衡转化率最高
D.催化剂①、②分别适合于250℃和450℃左右脱氮
科目:gzhx 来源: 题型:
在2L密闭容器中,合成氨反应N2(g)+3H2(g)![]() 2NH3(g)达到平衡。请回答下列问题:
2NH3(g)达到平衡。请回答下列问题:
(1) 已知:450℃时NH3的浓度大于550℃时,则正反应是______ __热反应;
(2) 反应进程中:0~2s内N2的物质的量由2mol变为1mol,则υ(H2)=___________;
(3) 能说明该反应已经达到平衡状态的是_________ __;
A.c(N2)=c(H2)=c (NH3) B.容器内压强保持不变
C.υ(N2)=3υ(H2) D.容器内的密度保持不变
(4) 可使该反应的反应速率增大,且平衡向正反应方向移动的措施是__________。
A.及时分离出NH3气体 B.适当升高温度
C. 增大压强 D.选择高效的催化剂
科目:gzhx 来源: 题型:
下表是氧族元素的相关性质
| 性质\元素 | 8O | 16S | 34Se | 52Te |
| 单质熔点(℃) | ―218.4 | 113 | 450 | |
| 单质沸点(℃) | ―183 | 444.6 | 685 | 1390 |
| 主要化合价 | ―2 | ―2,+4,+6 | ―2,+4,+6 | |
| 原子半径 | 逐渐增大 | |||
| 单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
请根据表回答下列问题:
(1)硒的熔点范围可能是
(2)氢硒酸有较强的 (填“氧化性”或“还原性”),因此放在空气中长期保存易变质,其可能发生在化学反应方程式为 。
(3)工业上Al2Te3可用来制备H2Te,完成下列化学方程式:
□Al2Te3+□ ===Al(OH)3↓+□H2Te↑
(4)已知在常温下,H2和S反应生成17gH2S放出56.1KJ的热量,试写出硫化氢分解的热化学方程式: 。
(5)右图所示为氧族元素单质与H2反应过程中的
能量变化示意图,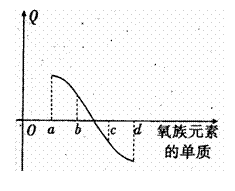 其中a、b、c、d分另表示
其中a、b、c、d分另表示
氧族中某一元素的单质,Q为相同物质的量
的单质与H2反应放出的热量。则:
a代表 ,c代表
(均可单质名称)
科目:gzhx 来源:高考三人行 化学 题型:013
已知在常温下发生如下反应:
①2F2+2H2O=4HF+O2(很激烈)
②2F2+2OH-(5%)=2F-+OF2+H2O
③XCl+H2O=HXO+HCl
且在450℃和CuCl2催化下,发生4HCl+O2=2Cl2+2H2O的反应,由此可以判断F2、Cl2、O2、X2的氧化性强弱顺序为
[ ]
科目:gzhx 来源: 题型:
 体积相同的密闭容器中均充入1mol X和1mol Y,分别于300℃和500℃开始发生反应:X(g)+Y(g)⇌3Z(g),Z的含量(Z%)随时间t的变化如图所示.已知在t3时刻改变曲线b某一实验条件,下列判断正确的是( )
体积相同的密闭容器中均充入1mol X和1mol Y,分别于300℃和500℃开始发生反应:X(g)+Y(g)⇌3Z(g),Z的含量(Z%)随时间t的变化如图所示.已知在t3时刻改变曲线b某一实验条件,下列判断正确的是( )| A、曲线a是500℃时的图象 | ||
B、从0到t1时刻,反应物X(g)的
| ||
C、t2时刻生成物Z的量
| ||
| D、t3时刻改变的条件可能是降温 |
科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:

科目:gzhx 来源: 题型:
| 1 | 2 |
科目:gzhx 来源: 题型:
 通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能.键能的大小可用于估算化学反应的反应热(△H).
通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能.键能的大小可用于估算化学反应的反应热(△H).| 化学键 | Cl-Cl | H-H | H-Cl | N≡N |
| 键能/kJ•mol | 243 | 436 | 431 | 946 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
科目:gzhx 来源: 题型: