
科目:gzhx 来源: 题型:
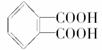
它是在一定条件下由两种有机物A和B以物质的量之比2∶1通过聚合反应合成的,合成过程中伴有水分子生成,请分别写出A、B的结构简式A_________________,B_________________。
科目:gzhx 来源:选修高手化学人教·有机化学基础 人教版 题型:022
DAP是电器和仪表部件中常用的一种高分子化合物,它的结构简式为
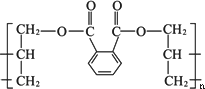
它是在一定条件下由两种有机物A和B以物质的量之比2∶1通过聚合反应合成的,合成过程中伴有水分子生成,请分别写出A、B的结构简式A________,B________.
科目:gzhx 来源: 题型:
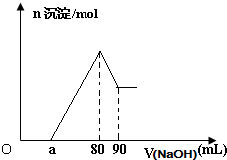 将一块镁铝合金投入一定体积的1mol/L稀盐酸中,待合金完全溶解后往溶液里滴入1mol/L的NaOH溶液,生成沉淀物质的量与加入NaOH溶液体积的关系如图.下列说法中不正确的是( )
将一块镁铝合金投入一定体积的1mol/L稀盐酸中,待合金完全溶解后往溶液里滴入1mol/L的NaOH溶液,生成沉淀物质的量与加入NaOH溶液体积的关系如图.下列说法中不正确的是( )科目:gzhx 来源: 题型:
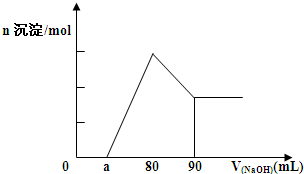 将一块镁铝合金投入1mol•L-1 的一定体积的稀盐酸中,待合金完全溶解后往溶液里滴入1mol•L-1的NaOH溶液,生成沉淀物质的量与加入NaOH溶液体积(单位为mL)的关系如图,下列说法中不正确的是( )
将一块镁铝合金投入1mol•L-1 的一定体积的稀盐酸中,待合金完全溶解后往溶液里滴入1mol•L-1的NaOH溶液,生成沉淀物质的量与加入NaOH溶液体积(单位为mL)的关系如图,下列说法中不正确的是( )| A、由图可以确定该镁铝合金中铝的质量为0.27克 | ||
| B、当滴入1 mol•L-1的NaOH溶液85mL时,所得沉淀的成分为Mg(OH)2和Al(OH)3 | ||
C、由图可以确定该合金中镁铝物质的量之比
| ||
| D、由图可以确定a的取值范围为:0≤a≤50 |
科目:gzhx 来源: 题型:
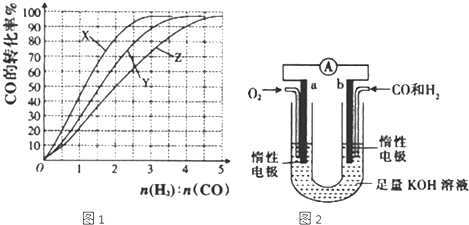
科目:gzhx 来源: 题型:

科目:gzhx 来源: 题型:
 将一块镁铝的合金投入1mol•L-1的一定体积的稀盐酸中,待合金完全溶解后,往溶液里滴入1mol•L-1的NaOH溶液,生成沉淀物质的量与加入NaOH溶液体积(单位mL)的关系如图.下列说法中不正确的是( )
将一块镁铝的合金投入1mol•L-1的一定体积的稀盐酸中,待合金完全溶解后,往溶液里滴入1mol•L-1的NaOH溶液,生成沉淀物质的量与加入NaOH溶液体积(单位mL)的关系如图.下列说法中不正确的是( )科目:gzhx 来源: 题型:
| 催化剂 |
| 催化剂 |
| 催化剂 |
| 1 |
| 5 |
科目:gzhx 来源: 题型:
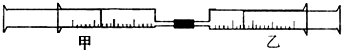
| 实验序号 | 甲针筒内物质 | 乙针筒内物质 | 甲针筒的现象 |
| 1 | 10mL FeSO4溶液 | 10mL NH3 | 生成白色沉淀,后变色 |
| 2 | 15mL H2S | 10mL SO2 | 活塞自动向内移动,析出浅黄色固体 |
| 3 | 10mL Cl2 | 40mL NH3 | |
| 4 | 25mL混合气体 | 10mL H2O(l) | 剩有无色气体,活塞自动向内移动 |
科目:gzhx 来源: 题型:

(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有____________。
a.容量瓶 b.烧杯 c.烧瓶
(2)步骤Ⅱ取样分析溶液中的Fe2+、Fe3+的含量,目的是____________。
a.控制溶液中Fe2+与Fe3+含量比
b.确定下一步还原所需铁的量
c.确定氧化Fe2+所需NaClO3的量
d.确保铁的氧化物酸溶完全
(3)用NaClO3氧化时反应方程式如下:
6FeSO4+NaClO3+3H2SO4====3Fe2(SO4)3+NaCl+3H2O
若改用HNO3氧化,则反应方程式如下:
6FeSO4+2HNO3+3H2SO4====3Fe2(SO4)3+2NO↑+4H2O
已知1 mol HNO3价格0.16元、1 mol NaClO3价格0.45元,评价用HNO3代替NaClO3作氧化剂的利弊。利是_________________________,弊是_______________________________。
聚合硫酸铁溶液中![]() 与Fe3+物质的量之比不是3∶2。根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中
与Fe3+物质的量之比不是3∶2。根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中![]() 与Fe3+物质的量之比。
与Fe3+物质的量之比。
(4)测定时所需的试剂_____________。
a.NaOH b.FeSO4 c.BaCl2 d.NaClO3
(5)需要测定___________和___________的质量(填写化合物的化学式)。
(6)选出测定过程中所需的基本操作___________(按操作先后顺序列出)。
a.萃取、分液 b.过滤、洗涤 c.蒸发、结晶 d.冷却、称量
e.烘干或灼烧
科目:gzhx 来源:2011-2012学年安徽省江南十校高三素质教育联考理科综合试卷化学部分(解析版) 题型:填空题
(14分)W、X、Y、Z是四种常见的短周期元素,其原子序数依次增大,其它相关信息如下表所示

(1 )X位于元素周期表中第________周期第 _______族;Y基态原子的电子排布式为_______。
(2) 在W-H、X-H两种共价键中,键的极性较强的是_______,元素Y与W按原子个数比1 : 3形成的化合物所属的晶体类型是_______。
(3) W的一种氢化物(W2H4)与W2X4发生反应: ,反应中若形成
,反应中若形成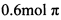 键放热103.9k!。则该反应的
键放热103.9k!。则该反应的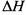 =_______。
=_______。
(4) 元素X、Y、Z可形成1:1:1型化合物A,已知A在热的碱性溶液中分解得到物质的量之比为1 : 2的两种盐,写出该反应的化学方程式_______。
科目:gzhx 来源: 题型:

(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有______。
a.容量瓶
b.烧杯
c.烧瓶
(2)步骤Ⅱ取样分析溶液中的Fe2+、Fe3+的含量,目的是_____。
a.控制溶液中Fe2+与Fe3+含量比
b.确定下一步还原所需铁的量
c.确定氧化Fe2+所需NaClO3的量
d.确保铁的氧化物酸溶完全
(3)用NaClO3氧化时反应方程式如下:
6FeSO4+NaClO3+3H2SO4====3Fe2(SO4)3+NaCl+3H2O
若改用HNO3氧化,则反应方程式如下:
6FeSO4+2HNO3+3H2SO4====3Fe2(SO4)3+2NO↑+4H2O
已知1 mol HNO3价格0.16元、1 mol NaClO3价格0.45元,评价用HNO3代替NaClO3作氧化剂的利弊。利是_________________________,弊是______________________________。
聚合硫酸铁溶液中![]() 与Fe3+物质的量之比不是3∶2。根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中
与Fe3+物质的量之比不是3∶2。根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中![]() 与Fe3+物质的量之比。
与Fe3+物质的量之比。
(4)测定时所需的试剂___________。
a.NaOH b.FeSO4 c.BaCl2 d.NaClO3
(5)需要测定___________________和___________________的质量。(填写化合物的化学式)
(6)选出测定过程中所需的基本操作_________________________(按操作先后顺序列出)。
a.萃取、分液
b.过滤、洗涤
c.蒸发、结晶
d.冷却、称量
e.烘干或灼烧
科目:gzhx 来源: 题型:
下列各组有机物,它们以任意物质的量之比混合,只要混合物的物质的量一定,在完全燃烧时,消耗的氧气的量恒定不变的是( )
A.C3H6和C3H8
B.C4H6和C3H8
C.C6H10和C6H6
D.C3H8和C4H4
科目:gzhx 来源: 题型:
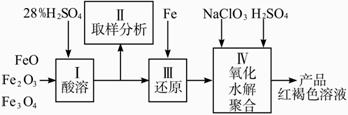
实验步骤如下:
(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有________。
(a)容量瓶________(b)烧杯________(c)烧瓶
(2)步骤Ⅱ取样分析溶液中的Fe2+、Fe3+的含量,目的是________。
(a)控制溶液中Fe2+与Fe3+含量比
(b)确定下一步还原所需铁的量
(c)确定氧化Fe2+所需NaClO3的量
(d)确保铁的氧化物酸溶完全
(3)用NaClO3氧化时反应方程式如下:
6FeSO4+NaClO3+3H2SO4![]() 3Fe2(SO4)3+NaCl+3H2O
3Fe2(SO4)3+NaCl+3H2O
若改用HNO3氧化,则反应方程式如下
6FeSO4+2HNO3+3H2SO4![]() 3Fe2(SO4)3+NO↑+4H2
3Fe2(SO4)3+NO↑+4H2
已知1 mol HNO3价格为0.16元、1 mol NaClO3价格为0.45元,评价用HNO3代替NaClO3作氧化剂的利弊,利是________,弊是________。
(4)聚合硫酸铁溶液中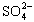 与Fe3+物质的量之比不是3∶2。根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中
与Fe3+物质的量之比不是3∶2。根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中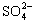 与Fe3+物质的量之比。
与Fe3+物质的量之比。
测定时所需的试剂________。
(a) NaOH (b)FeSO4 (c) BaCl2 (d) NaClO3
(5)需要测定________和________的质量(填写化合物的化学式)。
(6)选出测定过程中所需的基本操作________(按操作先后顺序列出)。
(a)萃取、分液 (b)过滤、洗涤 (c)蒸发、结晶 (d)冷却、称量 (e)烘干或灼烧
科目:gzhx 来源: 题型:
已知盐酸加到品红溶液中,由于酸性增强使品红溶液的红色加深。试推测:
(1)向品红溶液中通入过量SO2的过程中,观察到的现象为_____ ____;
加热后的现象为____ ____。
(2)向品红溶液中通入过量Cl2的过程中,观察到的现象为_____ ____;
加热后的现象为____ _____。
(3)向品红溶液中通入物质的量之比为1∶1的SO2和Cl2后现象________。
科目:gzhx 来源: 题型:
A.C3H6和C3H8 B.C4H6和C3H8
C.C6H10和C6H6 D.C3H8和C4H4
科目:gzhx 来源:2012届安徽省江南十校高三素质教育联考理科综合试卷化学部分(解析版) 题型:填空题
(14分)W、X、Y、Z是四种常见的短周期元素,其原子序数依次增大,其它相关信息如下表所示
(1 )X位于元素周期表中第________周期第_______族;Y基态原子的电子排布式为_______。
(2) 在W-H、X-H两种共价键中,键的极性较强的是_______,元素Y与W按原子个数比1 : 3形成的化合物所属的晶体类型是_______。
(3) W的一种氢化物(W2H4)与W2X4发生反应: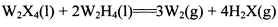 ,反应中若形成
,反应中若形成 键放热103.9k!。则该反应的
键放热103.9k!。则该反应的 =_______。
=_______。
(4) 元素X、Y、Z可形成1:1:1型化合物A,已知A在热的碱性溶液中分解得到物质的量之比为1 : 2的两种盐,写出该反应的化学方程式_______。
科目:gzhx 来源:2011-2012学年海南省嘉积中学高一上学期教学质量监测三化学试卷 题型:填空题
已知盐酸加到品红溶液中,由于酸性增强使品红溶液的红色加深。试推测:
(1)向品红溶液中通入过量SO2的过程中,观察到的现象为_____ ____;
加热后的现象为____ ____。
(2)向品红溶液中通入过量Cl2的过程中,观察到的现象为_____ ____;
加热后的现象为____ _____。
(3)向品红溶液中通入物质的量之比为1∶1的SO2和Cl2后现象________。
科目:gzhx 来源:2014届海南省高一上学期教学质量监测三化学试卷 题型:填空题
已知盐酸加到品红溶液中,由于酸性增强使品红溶液的红色加深。试推测:
(1)向品红溶液中通入过量SO2的过程中,观察到的现象为_____ ____;
加热后的现象为____ ____。
(2)向品红溶液中通入过量Cl2的过程中,观察到的现象为_____ ____;
加热后的现象为____ _____。
(3)向品红溶液中通入物质的量之比为1∶1的SO2和Cl2后现象________。
科目:gzhx 来源: 题型:
A.4∶5 B.2∶3 C.2∶5 D.1∶2