
科目:gzhx 来源: 题型:阅读理解
| ||

科目:gzhx 来源: 题型:
高氯酸铵(NH4ClO4)是复合火箭推进剂的重要成分,实验室可通过下列反应制取
NH4ClO4 (aq)+NH4Cl(aq)![]() NH4ClO4 (aq)+NaCl(aq)
NH4ClO4 (aq)+NaCl(aq)
(1)若NH4Cl用氨气和浓盐酸代替,上述反应不需要外界供
热就能进行,其原因是 。
(2)反应得到的混合溶液中NH4ClO4和NaCl的质量分数分别为0.30和0.l5(相关物质的溶解度曲线见图9)。从混合溶液中获得较多NH4ClO4晶体的实验操作依次为(填操作名称)
、干燥。
(3)样品中NH4CIO4的含量可用蒸馏法进行测定,蒸馏装置如图10所示(加热和仪器固定装置已略去),实验步骤如下:
步骤1:按图10所示组装仪器,检查装置气密性。
步骤2:准确称取样品a g(约0.5g)于蒸馏烧瓶中,加入约150mL水溶解。
步骤3:准确量取40.00mL约![]() H2SO4 溶解于锥形瓶中。
H2SO4 溶解于锥形瓶中。
步骤4:经滴液漏斗向蒸馏瓶中加入20mL NaOH 溶液。
NaOH 溶液。
步骤5:加热蒸馏至蒸馏烧瓶中剩余约100mL溶液。
步骤6:用新煮沸过的水冲洗冷凝装置2~3次,洗涤液并入锥形瓶中。
步骤7:向锥形瓶中加入酸碱指示剂,用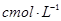 NaOH标准溶液滴定至终点,消耗NaOH标准溶液
NaOH标准溶液滴定至终点,消耗NaOH标准溶液
步骤8.将实验步骤1-7重复2次
①步骤3中,准确量取40.00ml H2SO4 溶液的玻璃仪器是________。
②步骤1-7中确保生成的氨被稀硫酸完全吸收的实验是_____(填写步骤号)。
③为获得样品中NH4ClO4的含量,还需补充的实验是 _____
科目:gzhx 来源:2011年普通高等学校招生全国统一考试化学卷(江苏) 题型:实验题
高氯酸铵(NH4ClO4)是复合火箭推进剂的重要成分,实验室可通过下列反应制取
NH4ClO4 (aq)+NH4Cl(aq) NH4ClO4 (aq)+NaCl(aq)
NH4ClO4 (aq)+NaCl(aq)
(1)若NH4Cl用氨气和浓盐酸代替,上述反应不需要外界供
热就能进行,其原因是 。
(2)反应得到的混合溶液中NH4ClO4和NaCl的质量分数分别为0.30和0.l5(相关物质的溶解度曲线见图9)。从混合溶液中获得较多NH4ClO4晶体的实验操作依次为(填操作名称)
、干燥。

(3)样品中NH4CIO4的含量可用蒸馏法进行测定,蒸馏装置如图10所示(加热和仪器固定装置已略去),实验步骤如下:
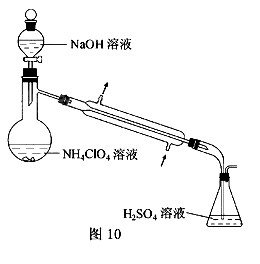
步骤1:按图10所示组装仪器,检查装置气密性。
步骤2:准确称取样品a g(约0.5g)于蒸馏烧瓶中,加入约150mL水溶解。
步骤3:准确量取40.00mL约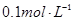 H2SO4 溶解于锥形瓶中。
H2SO4 溶解于锥形瓶中。
步骤4:经滴液漏斗向蒸馏瓶中加入20mL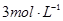 NaOH 溶液。
NaOH 溶液。
步骤5:加热蒸馏至蒸馏烧瓶中剩余约100mL溶液。
步骤6:用新煮沸过的水冲洗冷凝装置2~3次,洗涤液并入锥形瓶中。
步骤7:向锥形瓶中加入酸碱指示剂,用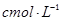 NaOH标准溶液滴定至终点,消耗NaOH标准溶液
NaOH标准溶液滴定至终点,消耗NaOH标准溶液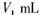
步骤8.将实验步骤1-7重复2次
①步骤3中,准确量取40.00ml H2SO4 溶液的玻璃仪器是________。
②步骤1-7中确保生成的氨被稀硫酸完全吸收的实验是_____(填写步骤号)。
③为获得样品中NH4ClO4 的含量,还需补充的实验是 _____
科目:gzhx 来源:2011-2012学年上海市普陀区高三上学期期末质量抽测化学试卷 题型:实验题
为探究铜与浓硫酸的反应,某兴趣小组进行了如下实验。
【实验1】铜与浓硫酸反应,实验装置如图所示。

(1)、装置A中发生反应的化学方程式为:
(2)、熄灭酒精灯后,因为有导管存在,B中的液体不会倒吸,其原因是: 。
拆除装置前,不打开胶塞,为了使装置中的残留气体完全被吸收,应当采取的操作是: 。
【实验2】实验中发现试管内除了产生白色固体外,在铜丝表面还有黑色固体甲生成,甲中可能含有氧化铜、氧化亚铜、硫化铜、硫化亚铜。
查阅资料:
①氧化亚铜在酸性环境下会发生自身氧化还原反应生成Cu2+和铜单质,在空气中充分煅烧,可以转化为氧化铜。
②硫化铜和硫化亚铜常温下都不溶于稀盐酸,在空气中充分煅烧,均转化为氧化铜和二氧化硫。
为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如下实验:
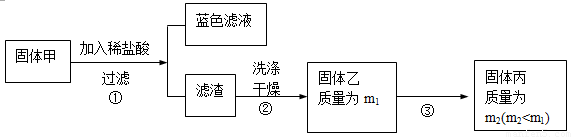
(3)、步骤②中检验滤渣是否洗涤干净的实验方法是: 。
(4)、固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有:
。
(5)、确定乙是否煅烧完全的操作是: 。
(6)、煅烧过程中一定发生的化学反应方程式为: 。
高氯酸铵(NH4ClO4)是复合火箭推进剂的重要成分,实验室可通过下列反应制取:
NaClO4(aq)+NH4Cl(aq) NH4ClO4(aq)+NaCl(aq)
NH4ClO4(aq)+NaCl(aq)
(7)、用氨气和浓盐酸代替NH4Cl,上述反应不需要外界供热就能进行,其原因是:
。
(8)、反应得到的混合溶液中NH4ClO4和NaCl的质量分数分别为0.30和0.l5(相关物质的溶解度曲线如下图)。从混合溶液中获得较多NH4ClO4晶体的实验操作依次为(填操作名称)蒸发浓缩, ,过滤, 、干燥。

为了测定样品中NH4ClO4的含量,装置如上图所示(加热装置、仪器固定装置已略去),实验步骤如下:
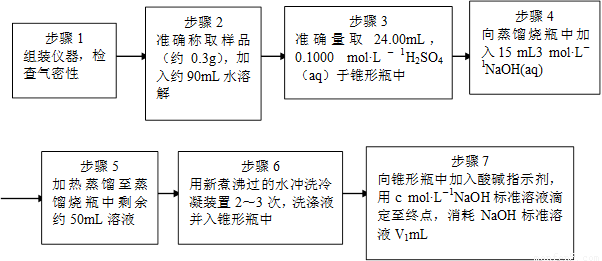
(9)、步骤3中,准确取用24.00 mL H2SO4(aq)的玻璃仪器是 。
(10)、实验中确保生成的氨被稀硫酸完全吸收的实验步骤是 (填写步骤编号)。
(11)、必须重复实验2~3次,其原因是 。
(12)、如果0.320 g试样中含NH4ClO4的准确值为0.095g,而实验测定结果是0.092g 。该实验
的相对误差为 。
科目:gzhx 来源:2012届上海市普陀区高三上学期期末质量抽测化学试卷 题型:实验题
为探究铜与浓硫酸的反应,某兴趣小组进行了如下实验。
【实验1】铜与浓硫酸反应,实验装置如图所示。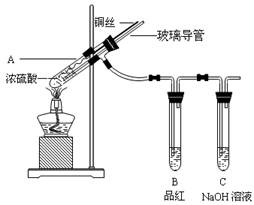
(1)、装置A中发生反应的化学方程式为:
(2)、熄灭酒精灯后,因为有导管存在,B中的液体不会倒吸,其原因是: 。
拆除装置前,不打开胶塞,为了使装置中的残留气体完全被吸收,应当采取的操作是: 。
【实验2】实验中发现试管内除了产生白色固体外,在铜丝表面还有黑色固体甲生成,甲中可能含有氧化铜、氧化亚铜、硫化铜、硫化亚铜。
查阅资料:
①氧化亚铜在酸性环境下会发生自身氧化还原反应生成Cu2+和铜单质,在空气中充分煅烧,可以转化为氧化铜。
②硫化铜和硫化亚铜常温下都不溶于稀盐酸,在空气中充分煅烧,均转化为氧化铜和二氧化硫。
为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如下实验: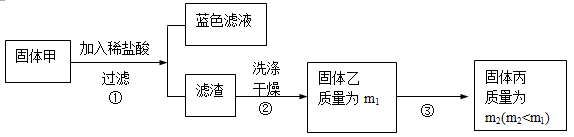
(3)、步骤②中检验滤渣是否洗涤干净的实验方法是: 。
(4)、固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有:
。
(5)、确定乙是否煅烧完全的操作是: 。
(6)、煅烧过程中一定发生的化学反应方程式为: 。
高氯酸铵(NH4ClO4)是复合火箭推进剂的重要成分,实验室可通过下列反应制取:
NaClO4(aq)+NH4Cl(aq) NH4ClO4(aq)+NaCl(aq)
NH4ClO4(aq)+NaCl(aq)
(7)、用氨气和浓盐酸代替NH4Cl,上述反应不需要外界供热就能进行,其原因是:
。
(8)、反应得到的混合溶液中NH4ClO4和NaCl的质量分数分别为0.30和0.l5(相关物质的溶解度曲线如下图)。从混合溶液中获得较多NH4ClO4晶体的实验操作依次为(填操作名称)蒸发浓缩, ,过滤, 、干燥。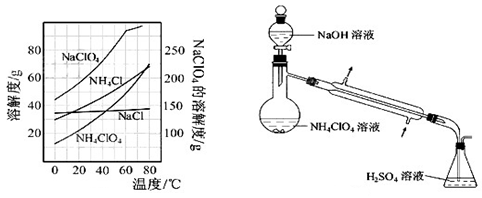
为了测定样品中NH4ClO4的含量,装置如上图所示(加热装置、仪器固定装置已略去),实验步骤如下:
(9)、步骤3中,准确取用24.00 mL H2SO4(aq)的玻璃仪器是 。
(10)、实验中确保生成的氨被稀硫酸完全吸收的实验步骤是 (填写步骤编号)。
(11)、必须重复实验2~3次,其原因是 。
(12)、如果0.320 g试样中含NH4ClO4的准确值为0.095g,而实验测定结果是0.092g。该实验
的相对误差为 。
科目:gzhx 来源:2011年普通高等学校招生全国统一考试化学卷(江苏) 题型:实验题
高氯酸铵(NH4ClO4)是复合火箭推进剂的重要成分,实验室可通过下列反应制取
NH4ClO4 (aq)+NH4Cl(aq) NH4ClO4 (aq)+NaCl(aq)
NH4ClO4 (aq)+NaCl(aq)
(1)若NH4Cl用氨气和浓盐酸代替,上述反应不需要外界供
热就能进行,其原因是 。
(2)反应得到的混合溶液中NH4ClO4和NaCl的质量分数分别为0.30和0.l5(相关物质的溶解度曲线见图9)。从混合溶液中获得较多NH4ClO4晶体的实验操作依次为(填操作名称)
、干燥。
(3)样品中NH4CIO4的含量可用蒸馏法进行测定,蒸馏装置如图10所示(加热和仪器固定装置已略去),实验步骤如下: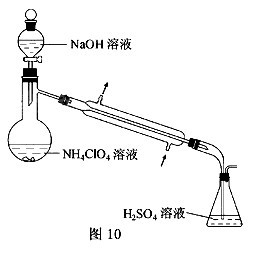
步骤1:按图10所示组装仪器,检查装置气密性。
步骤2:准确称取样品a g(约0.5g)于蒸馏烧瓶中,加入约150mL水溶解。
步骤3:准确量取40.00mL约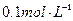 H2SO4 溶解于锥形瓶中。
H2SO4 溶解于锥形瓶中。
步骤4:经滴液漏斗向蒸馏瓶中加入20m L
L NaOH 溶液。
NaOH 溶液。
步骤5:加热蒸馏至蒸馏烧瓶中剩余约100mL溶液。
步骤6:用新煮沸过的水冲洗冷凝装置2~3次,洗涤液并入锥形瓶中。
步骤7:向锥形瓶中加入酸碱指示剂,用 NaOH标准溶液滴定至终点,消耗NaOH标准溶液
NaOH标准溶液滴定至终点,消耗NaOH标准溶液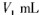
步骤8.将实验步骤1-7重复2次
①步骤3中,准确量取40.00ml H2SO4 溶液的玻璃仪器是________。
②步骤1-7中确保生成的氨被稀硫酸完全吸收的实验是_____(填写步骤号)。
③为获得样品中NH4ClO4 的含量,还需补充的实验是 _____
科目:gzhx 来源:2011-2012学年江苏省高三百校大联考一模考试化学试卷 题型:实验题
(15分)氯酸钾是无机盐工业的重要产品之一,可通过反应:NaC1O3+KC1
KC1O3↓+NaC1制取。
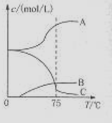
(1)实验室制取氯酸钠可通过反应:3C12+6NaOH 5NaC1+NaC1O3+3H2O,今在—5℃的NaOH溶液中通入适量C12(平衡常数K=1.09×1012),此时C12的氧化产物主要是 ;将溶液加热,溶液中主要离子浓度随温度的变化如右图所示,图中A、B、C依次表示的离子是 。
5NaC1+NaC1O3+3H2O,今在—5℃的NaOH溶液中通入适量C12(平衡常数K=1.09×1012),此时C12的氧化产物主要是 ;将溶液加热,溶液中主要离子浓度随温度的变化如右图所示,图中A、B、C依次表示的离子是 。
(2)工业上制取氯酸钠采用在热的石灰乳通入氯气,然
后结晶除去氯化钙后,再加入一种钠盐,合适的钠盐是
。
(3)北美、欧洲国家生产氯酸钠用二级精制盐水。采用
无隔膜电解法获得,生产过程中涉及的主要的化学反应式如下:
总反应式:NaC1+3H2O NaC1O3+3H2↑
NaC1O3+3H2↑
阳极:2C1——2e—
C12↑阴极:2H2O+2e—
H2↑+2OH—
液相反应:C12+H2O HC1O+H++C1—
HC1O
HC1O+H++C1—
HC1O H++C1O—
H++C1O—
2HC1O+CO— C1O3—+2C1—+2H+
①
精制食盐水时,要除去其中的Ca2+、Mg2+及SO42—并得到中性溶液,依次加入的化学试剂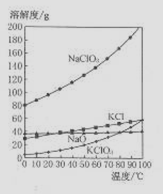
② 是 、 、 ;过滤,滤液中再加入适量的稀盐酸,得一级精制盐水再经离子交换处理或膜处理得到二级精制盐水。
②电解时,必须在食盐水中加入Na2Cr2O2,其目的是防止 (填离子符号)电解过程中在阴极上放电。
(4)若NaC1O2与KC1的混合溶液中NaC1O3与KC1的质量分数分别为0.290和0.203(相关物质的溶解度曲线如右图)。从混合溶液中获得较多KC1O3晶体的实验操作依次
为 (填操作名称)、干燥。
(5)样品中C1O3—的含量可用滴定法进行测定,实验步骤
如下:
步骤1:准确称取样品ag(约2.20g),经溶解、定容等步骤准确配制1000mL溶液。
步骤2:从上述容量瓶中取出10.00mL于锥形瓶中,准确加入25mL1000mol/L(NH4)2Fe(SO4)2。溶液(过量),加入75mL硫酸和磷酸配成的混酸,静置10min。
步骤3:再在锥形瓶中加入100mL蒸馏水及某种氧化还原反应指示剂,用0.200mol/LK2Cr2O2标准溶液滴定至终点。
步骤4: 。
步骤5:数据处理与计算。
①步骤2,静置10min的目的是 。
②步骤3中K2Cr2O2标准溶液应盛放在 中(填仪器名称)。
③为了确定样品中C1O2—的质量分数,步骤4的操作内容是 。
科目:gzhx 来源:2014届山东省济宁市高一上学期期中质量检测化学试卷 题型:选择题
将等物质的量的Na2O和Na2O2分别投入到足量且等质量的水中,得到溶质质量分数分别为a%和b%的两种溶液,则a和b的关系是 ( )
A.Na2O2和CO2 B.NaOH和CO2 C.Na和O2 D.Na2CO3和HCl
科目:gzhx 来源:2014届黑龙江大庆铁人中学高一上学期期中考试化学试卷 题型:选择题
将等物质的量的Na2O和Na2O2分别投入到足量且等质量的水中,得到溶质质量分数分别为a%和b%的两种溶液,则a和b的关系是 ( )
A.a=b B.a>b C.a<b D.无法确定
科目:gzhx 来源: 题型:阅读理解
为探究铜与浓硫酸的反应,某兴趣小组进行了如下实验。
【实验1】铜与浓硫酸反应,实验装置如图所示。
(1)、装置A中发生反应的化学方程式为:
(2)、熄灭酒精灯后,因为有导管存在,B中的液体不会倒吸,其原因是: 。
拆除装置前,不打开胶塞,为了使装置中的残留气体完全被吸收,应当采取的操作是: 。
【实验2】实验中发现试管内除了产生白色固体外,在铜丝表面还有黑色固体甲生成,甲中可能含有氧化铜、氧化亚铜、硫化铜、硫化亚铜。
查阅资料:
①氧化亚铜在酸性环境下会发生自身氧化还原反应生成Cu2+和铜单质,在空气中充分煅烧,可以转化为氧化铜。
②硫化铜和硫化亚铜常温下都不溶于稀盐酸,在空气中充分煅烧,均转化为氧化铜和二氧化硫。
为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如下实验:
(3)、步骤②中检验滤渣是否洗涤干净的实验方法是: 。
(4)、固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有:
。
(5)、确定乙是否煅烧完全的操作是: 。
(6)、煅烧过程中一定发生的化学反应方程式为: 。
高氯酸铵(NH4ClO4)是复合火箭推进剂的重要成分,实验室可通过下列反应制取:
NaClO4(aq)+NH4Cl(aq) NH4ClO4(aq)+NaCl(aq)
(7)、用氨气和浓盐酸代替NH4Cl,上述反应不需要外界供热就能进行,其原因是:
。
(8)、反应得到的混合溶液中NH4ClO4和NaCl的质量分数分别为0.30和0.l5(相关物质的溶解度曲线如下图)。从混合溶液中获得较多NH4ClO4晶体的实验操作依次为(填操作名称)蒸发浓缩, ,过滤, 、干燥。
为了测定样品中NH4ClO4的含量,装置如上图所示(加热装置、仪器固定装置已略去),实验步骤如下:
(9)、步骤3中,准确取用24.00 mL H2SO4(aq)的玻璃仪器是 。
(10)、实验中确保生成的氨被稀硫酸完全吸收的实验步骤是 (填写步骤编号)。
(11)、必须重复实验2~3次,其原因是 。
(12)、如果0.320 g试样中含NH4ClO4的准确值为0.095g,而实验测定结果是0.092g 。该实验
的相对误差为 。
科目:gzhx 来源: 题型:
将等物质的量的Na2O和Na2O2分别投入到足量且等质量的水中,得到溶质质量分数分别为a%和b%的两种溶液,则a和b的关系是( )
A.a=b B.a>b C.a<b D.无法确定
科目:gzhx 来源: 题型:
已知氨水浓度越大,密度越小。溶质质量分数分别为a%和5a%的氨水等体积混合,混合后NH3的质量分数为( )
A.3a% B.6a% C.>3a% D.<3a%
科目:gzhx 来源:龙之脉新教材完全解读 高中化学 必修1 配鲁科版 鲁科版 题型:013
|
已知氨水的密度为0.990 g/cm3时,NH3的质量分数为2%,氨水的密度为0.930 g/cm3时,NH3的质量分数为18%.NH3的质量分数分别为a %和5a %的氨水按等体积混和均匀后,混合溶液中NH3的质量分数为 | |
| [ ] | |
A. |
3a% |
B. |
6a% |
C. |
>3a% |
D. |
<3a% |
科目:gzhx 来源:甘肃省天水一中2012届高三百题集化学试题 题型:058
高氯酸铵(NH4ClO4)是复合火箭推进剂的重要成分,实验室可通过下列反应制取NaClO4(aq)+NH4Cl(aq)![]() NH4ClO4(aq)+NaCl(aq)
NH4ClO4(aq)+NaCl(aq)
(1)若NH4Cl用氨气和浓盐酸代替,上述反应不需要外界供热就能进行,其原因是________.
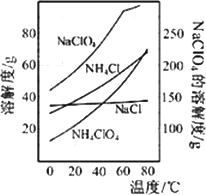
(2)反应得到的混合溶液中NH4ClO4和NaCl的质量分数分别为0.30和0.l5(相关物质的溶解度曲线见图).从混合溶液中获得较多NH4ClO4晶体的实验操作依次为(填操作名称)________、干燥.
(3)样品中NH4ClO4的含量可用蒸馏法进行测定,蒸馏装置如图所示(加热和仪器固定装置已略去),实验步骤如下:
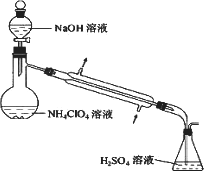
步骤1:按上图所示组装仪器,检查装置气密性.
步骤2:准确称取样品a g(约0.5g)于蒸馏烧瓶中,加入约150 mL水溶解.
步骤3:准确量取40.00 mL约0.1 mol·L-1H2SO4 溶解于锥形瓶中.
步骤4:经滴液漏斗向蒸馏瓶中加入20 mL 3 mol·L-1 NaOH溶液.
步骤5:加热蒸馏至蒸馏烧瓶中剩余约100 mL溶液.
步骤6:用新煮沸过的水冲洗冷凝装置2~3次,洗涤液并入锥形瓶中.
步骤7:向锥形瓶中加入酸碱指示剂,用c mol·L-1NaOH标准溶液滴定至终点,消耗NaOH标准溶液V1mL.
步骤8.将实验步骤1~7重复2次
①步骤3中,准确量取40.00 ml H2SO4 溶液的玻璃仪器是________.
②步骤1~7中确保生成的氨被稀硫酸完全吸收的实验是________(填写步骤号).
③为获得样品中NH4ClO4 的含量,还需补充的实验是________.
科目:gzhx 来源:必修一导学指导化学苏教版 苏教版 题型:021
|
已知氨水的密度为0.990 g·mL-1时,NH3的质量分数为2%,氨水的密度为0.930 g·mL-1时,NH3的质量分数为18%.溶质质量分数分别为a%和5a%的氨水按等体积混合后,混合溶液中NH3的质量分数为 | |
A. |
3a% |
B. |
6a% |
C. |
大于3a% |
D. |
小于3a% |
科目:gzhx 来源:必修一导学指导化学鲁科版 鲁科版 题型:013
|
将等物质的量的Na2O和Na2O2分别投入到足量且等质量的水中,得到溶质质量分数分别为a%和b%的两种溶液,则a和b的关系是 | |
| [ ] | |
A. |
a=b |
B. |
a>b |
C. |
a<b |
D. |
无法确定 |
科目:gzhx 来源:中学教材全解 高中化学 必修1 人教新课标 人教新课标 题型:021
|
若溶质质量分数分别为9x%和x%的两溶液等体积混合,其质量分数小于5x%,此溶质可能是 | |
A. |
H2SO4 |
B. |
NH3·H2O |
C. |
NaOH |
D. |
乙醇 |
科目:gzhx 来源:中学教材全解 高中化学 必修1 人教新课标 人教新课标 题型:013
|
将等物质的量的Na2O和Na2O2分别投入到足量且等质量的水中,得到溶质质量分数分别为a%和b%的两种溶液,则a和b的关系是 | |
| [ ] | |
A. |
a=b |
B. |
a>b |
C. |
a<b |
D. |
无法确定 |
科目:gzhx 来源: 题型:013
溶液配制过程能引起浓度偏高的是( )
①用1g98%的浓H2SO4加入4g水中,配制1∶4(质量比)硫酸溶液 ②配制一定物质的量浓度的H2SO4溶液时,最后在容量瓶中加水稀释至标线,塞好塞子摇动倒转混匀后,发现液面低于标线 ③在100mL水乙醇中,加入2g碘片,溶解后配制2%的碘酒溶液;〔![]() (乙醇)=0.7893gcm-3〕 ④在80mL水中,加入18.4mol•L-1 H2SO4,溶液20mL,配制3.68mol•L-1稀H2SO4 ⑤10%H2SO4溶液和90%H2SO4溶液等体积相混后配成50%的H2SO4溶液〔浓度越大,
(乙醇)=0.7893gcm-3〕 ④在80mL水中,加入18.4mol•L-1 H2SO4,溶液20mL,配制3.68mol•L-1稀H2SO4 ⑤10%H2SO4溶液和90%H2SO4溶液等体积相混后配成50%的H2SO4溶液〔浓度越大,![]() (gcm-3)越大〕⑥质量分数分别为5x%和x%的两种氨水等体积混合后配制3x%的氨水[浓度越大,
(gcm-3)越大〕⑥质量分数分别为5x%和x%的两种氨水等体积混合后配制3x%的氨水[浓度越大,![]() (gcm-3)越小]。
(gcm-3)越小]。
A.①③⑤ B.②④⑥ C.③④⑤ D.④⑤⑥