
科目:gzhx 来源: 题型:
(5分)某溶液中可能含有下列物质中的两种:HCl、NaOH、NaH2PO4、Na3 PO4、H3 PO4和Na2HPO4。
⑴这六种物质两两间可能形成 ① 种互相不发生反应的组合。
⑵取某种组合溶液,滴入甲基红指示剂后为黄色(pH=6.2),再滴入酚酞指示剂后仍是黄色(酚酞无色,pH≤8.0),则此组合是 ② 和 ③ 的组合液。
⑶取另一组合溶液xmL,以甲基橙作指示剂,用c mol/LNaOH溶液滴定至红橙色(此时pH约为9.6左右),又消耗V1mL(V>V1),试确定此组合溶液是 ④ 和 ⑤ 物质组成的。
科目:gzhx 来源:湖南长沙长郡中学2007届高三第一次月考、化学试卷 题型:058
为测定碳酸钙纯度(设含杂质SiO2),学生设计了如下几个实验方案,请回答每个方案中的问题.
[方案I](1)称取碳酸钙样品Mg;
(2)加入过量盐酸;
(3)收集并测定生成的气体体积VmL.
问题:如果称量样品时,砝码底部有一处未被实验者发现的残缺,那么测定的碳酸钙的纯度会________(偏高、偏低、无影响)
[方案II](1)称取碳酸钙样品Mg;
(2)用cmol/L盐酸VmL(过量)溶解样品;
(3)取溶解后的溶液![]() mL,用C′mol/LNaOH溶液滴定,恰好用去V′mL.
mL,用C′mol/LNaOH溶液滴定,恰好用去V′mL.
问题1:列出本实验中所用到的仪器名称(除铁架台及附件、烧杯之外)
________.
问题2:加盐酸后是否需要滤出SiO2后再用NaOH滴定________(填选项编号).
A、需要
B、不需要
C、均可
问题3:碳酸钙纯度计算公式________.
[方案III](1)称取碳酸钙样品Mg;
(2)高温(1000℃)煅烧直至质量不再发生变化,冷却后称量,质量为M′g.
问题1:为什么要煅烧至1000℃且“直至质量不再改变”?________;
问题2:本方案中的“冷却”应如何操作________.
[方案IV](1)称取碳酸钙样品Mg;
(2)加入足量Cmol/L盐酸VmL使之完全溶解;
(3)过滤并取滤液;
(4)在滤液中加入过量C′mol/LNa2CO3溶液V′mL;
(5)将步骤(4)中的沉淀滤出、洗涤、干燥、称重为M′g.
问题1:此方案中不需要的数据是________(填选项编号).
A、C、V
B、C′、V′
C、M′
D、M
问题2:为减少实验误差,必要的操作是________(填选项编号).
科目:gzhx 来源:四川省蓬安中学2007级高三第一次月考化学试题 题型:058
为测定碳酸钙纯度(设含杂质SiO2),学生设计了如下几个实验方案,请回答每个方案中的问题.
[方案I](1)称取碳酸钙样品Mg;
(2)加入过量盐酸;
(3)收集并测定生成的气体体积VmL.
问题:如果称量样品时,砝码底部有一处未被实验者发现的残缺,那么测定的碳酸钙的纯度会________(偏高、偏低、无影响)
[方案II](1)称取碳酸钙样品Mg;
(2)用cmol/L盐酸VmL(过量)溶解样品;
(3)取溶解后的溶液![]() mL,用C′mol/LNaOH溶液滴定,恰好用去V′mL.
mL,用C′mol/LNaOH溶液滴定,恰好用去V′mL.
问题1:列出本实验中所用到的仪器名称(除铁架台及附件、烧杯之外)________.
问题2:加盐酸后是否需要滤出SiO2后再用NaOH滴定________(填选项编号).
A、需要
B、不需要
C、均可
问题3:碳酸钙纯度计算公式________.
[方案III](1)称取碳酸钙样品Mg;(2)高温(1000℃)煅烧直至质量不再发生变化,冷却后称量,质量为M′g.
问题1:为什么要煅烧至1000℃且“直至质量不再改变”?________;
问题2:本方案中的“冷却”应如何操作________.
[方案IV](1)称取碳酸钙样品Mg;
(2)加入足量Cmol/L盐酸VmL使之完全溶解;
(3)过滤并取滤液;
(4)在滤液中加入过量C′mol/LNa2CO3溶液V′mL;
(5)将步骤(4)中的沉淀滤出、洗涤、干燥、称重为M′g.
问题1:此方案中不需要的数据是________(填选项编号).
A、C、V、B、C′、V′、C、M′、D、M
问题2:为减少实验误差,必要的操作是________(填选项编号).
A、精确测定Na2CO3溶液体积V′mL
B、精确配制浓度C′mol/LNa2CO3溶液
C、将步骤(3)所得沉淀洗涤,洗涤液也应并入(4)中
D、将步骤(3)所得沉淀洗涤、干燥、称量其质量M′g备用
问题3:步骤(5)中要将沉淀进行洗涤,如果未经洗涤,则测定的碳酸钙纯度将________(偏高、偏低、无影响).
综上所述,你认为4个方案中,最好的方案是________,其它方案的缺点分别是:
方案IV:沉淀的洗涤、干燥、称量操作过程复杂,容易造成较大误差;
方案________;________.
方案________;________.
科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:
用0.1mol/LNaOH溶液滴定100ml 0.1mol/L盐酸时,如果滴定误差在±0.1%以内,反应完毕后,溶液的PH范围为
A.6.9~7.1 B.3.3~10.7 C.4.3~9.7 D.6~8
科目:gzhx 来源:2010-2011学年江西省赣州市高三下学期十一县市期中联考(理综)化学部分 题型:选择题
下列说法正确的是( )

A、图甲表示某温度下,Cu(OH)2在溶液中达到沉淀溶解平衡后,改变溶液PH,Cu2+浓度的变化。由图可知点溶液未达到饱和,因此,点的Ksp[Cu(OH)2]小于b点。
B、图乙表示在室温时用一定浓度的盐酸滴定Vml同浓度的氨水。b点时溶液中C(NH4+)=C(Cl-),且溶液中水的电离程度最大。
C、图丙表示在室温时,用0.1mol/LNaOH溶液滴定30.00ml0.15mol/LCH3COOH溶液,点a所示溶液中C(Na+)>C(CH3COO-)>C(OH-)>C(H+)
D、图丁可表示同体积同PH的某一元强酸溶液①和某一元中强酸溶液②分别
与足量的锌粉发生反应生成V(H2)随时间(t)的变化情况。
科目:gzhx 来源:2013届辽宁省东北育才学校高二上学期期中考试化学试卷 题型:填空题
(16分)室温下,(1)pH=5和pH=3的两种盐酸以1:1体积比混合,该混合液的pH= ;
(2)将pH=8的NaOH溶液与pH=10的NaOH溶液等体积混合后,溶液中的pH= ;
(3)将0.1mol/L的盐酸和0.06mol/L的氢氧化钡以等体积混合后,溶液的pH= ;
(4)用0.01mol/LNaOH溶液滴定0.02mol/L 的硫酸,中和后加蒸馏水稀释到5mL,若滴定时终点判断有误差;①多加了1滴NaOH溶液②少加1滴NaOH溶液(设1滴为0.05mL),则①和②溶液中c(OH-)之比是 。
(5)0.1mol/L的NaHCO3溶液的pH为8,同浓度的NaAlO2溶液的pH为11。将两种溶液等体积混合,可能发生的现象是______,其主要原因是(用离子方程式表示)______。
(6)设某pH的硫酸中水电离出的c(H+)=1.0×10-amol/L,设相同的pH的硫酸铝中水电离出的c(H+)=1.0×10-bmol/L(a、b都是小于14的正整数),那么a和b之间应满足的数量关系是(用一个等式和一个不等式表示)。 、 。
科目:gzhx 来源: 题型:
(10分)为测定某种胃药中CaCO3含量,化学兴趣小组同学设计了以下两种方案(药片 中的其它成分与盐酸和NaOH均不反应,请回答有关问题:
中的其它成分与盐酸和NaOH均不反应,请回答有关问题:
(1)方案一:用右侧装置测量一定量样品与足量稀盐酸反应生成CO2的体积计算CaCO3的含量;装置中连通管X的作用是 。
(2)方案二:用滴定法测定,有以下几步操作:
A.配制0.1mol/LHC1溶液和0.100 mol/LNaOH溶液
B.取一粒药片(0. 100g),研碎后加入20mL蒸馏水
C.以酚酞为指示剂,用0.100 mol/LNaOH溶液滴定,用去体积为VmL达到终点
D.用酸式滴定管加入25ml 0.1mol/LHC1溶液,充分反应
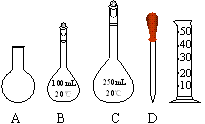 ①滴定过程的正确操作顺序为 (填字母)。
①滴定过程的正确操作顺序为 (填字母)。
滴定终点的判断依据是 。
②若需重复滴定4次,配制0.1mol/LHC1溶液需选用右图所示仪器中的 (填字母)。
③经测定,每次消耗NaOH溶液体积的平均值为13.00ml,则该胃药中CaCO3的质量分数为 ,
④与方案一相比,方案二的主要优点是:除了滴定法所需样品和试剂量少之外,还有 。
科目:gzhx 来源:2011-2012学年辽宁省东北育才学校高二上学期期中考试化学试卷 题型:填空题
(16分)室温下,(1)pH=5和pH=3的两种盐酸以1:1体积比混合,该混合液的pH= ;
(2)将pH=8的NaOH溶液与pH=10的NaOH溶液等体积混合后,溶液中 的pH= ;
的pH= ;
(3)将0.1mol/L的盐酸和0.06mol/L的氢氧化钡以等体积混合后,溶液的pH= ;
(4)用0.01mol/LNaOH溶液滴定0.02mol/L 的硫酸,中和后加蒸馏水稀释到5mL,若滴定时终点判断有误差;①多加了1滴NaOH溶液②少加1滴NaOH溶液(设1滴为0.05mL),则①和②溶液中c(OH-)之比是 。
(5)0.1mol/L的NaHCO3溶液的pH为8,同浓度的NaAlO2溶液的pH为11。将两种溶液等体积混合,可能发生的现象是______,其主要原因是(用离子方程式表示)______。
(6)设某pH的硫酸中水电离 出的c(H+)=1.0×10-amol/L,设相同的pH的硫酸
出的c(H+)=1.0×10-amol/L,设相同的pH的硫酸 铝中水电离出的c(H+)=1.0×10-bmol/L(a、b都是小于14的正整数),那么a和b之间应满足的数量关系是(用一个等式和一个不等式表示)。 、 。
铝中水电离出的c(H+)=1.0×10-bmol/L(a、b都是小于14的正整数),那么a和b之间应满足的数量关系是(用一个等式和一个不等式表示)。 、 。
科目:gzhx 来源: 题型:
用0.1mol/LNaOH溶液滴定0.1mol/LHCl,如达到滴定终点时不慎多加了1滴NaOH溶液(1滴溶液的体积约为0.05ml),继续加水至50ml,所得溶液的PH是
A.4 B.7.2 C.10 D.11.3
科目:gzhx 来源: 题型:单选题
科目:gzhx 来源: 题型:
(16分)室温下,(1)pH=5和pH=3的两种盐酸以1:1体积比混合,该混合液的pH= ;
(2)将pH=8的NaOH溶液与pH=10的NaOH溶液等体积混合后,溶液中的pH= ;
(3)将0.1mol/L的盐酸和0.06mol/L的氢氧化钡以等体积混合后,溶液的pH= ;
(4)用0.01mol/LNaOH溶液滴定0.02mol/L 的硫酸,中和后加蒸馏水稀释到5mL,若滴定时终点判断有误差;①多加了1滴NaOH溶液②少加1滴NaOH溶液(设1滴为0.05mL),则①和②溶液中c(OH-)之比是 。
(5)0.1mol/L的NaHCO3溶液的pH为8,同浓度的NaAlO2溶液的pH为11。将两种溶液等体积混合,可能发生的现象是______,其主要原因是(用离子方程式表示)______。
(6)设某pH的硫酸中水电离出的c(H+)=1.0×10-amol/L,设相同的pH的硫酸铝中水电离出的c(H+)=1.0×10-bmol/L(a、b都是小于14的正整数),那么a和b之间应满足的数量关系是(用一个等式和一个不等式表示)。 、 。
科目:gzhx 来源: 题型:
用 0.1 mol·LNaOH溶液滴定0.1mol·L
盐酸,如果达到滴定终点时不慎堕加了1滴NaOH溶液(1滴溶液约为0.05mL),继续加水至50 mL,所得溶液的PH是
A. 4 B.7.2 C. 10 D. 11.3
科目:gzhx 来源: 题型:
下列说法正确的是( )
A、图甲表示某温度下,Cu(OH)2在溶液中达到沉淀溶解平衡后,改变溶液PH,Cu2+浓度的变化。由图可知点溶液未达到饱和,因此,点的Ksp[Cu(OH)2]小于b点。
B、图乙表示在室温时用一定浓度的盐酸滴定Vml同浓度的氨水。b点时溶液中C(NH4+)=C(Cl-),且溶液中水的电离程度最大。
C、图丙表示在室温时,用0.1mol/LNaOH溶液滴定30.00ml0.15mol/LCH3COOH溶液,点a所示溶液中C(Na+)>C(CH3COO-)>C(OH-)>C(H+)
D、图丁可表示同体积同PH的某一元强酸溶液①和某一元中强酸溶液②分别
与足量的锌粉发生反应生成V(H2)随时间(t)的变化情况。
科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:
 (2011•奉贤区一模)常温下,用 0.1000mol/LNaOH溶液滴定 20.00mL0.1000mol/LCH3COOH溶液所得滴定曲线如下图.下列说法正确的是( )
(2011•奉贤区一模)常温下,用 0.1000mol/LNaOH溶液滴定 20.00mL0.1000mol/LCH3COOH溶液所得滴定曲线如下图.下列说法正确的是( )科目:gzhx 来源: 题型:阅读理解
科目:gzhx 来源: 题型:
 (1)根据右图回答下列问题:
(1)根据右图回答下列问题:科目:gzhx 来源: 题型:阅读理解