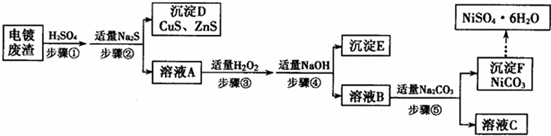
科目:gzhx 来源: 题型:
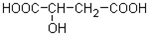 近年来流行喝果醋,苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等明显药效的健康食品.苹果酸是这种饮料的主要酸性物质,苹果酸的结构简式如图所示.请按要求回答问题:
近年来流行喝果醋,苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等明显药效的健康食品.苹果酸是这种饮料的主要酸性物质,苹果酸的结构简式如图所示.请按要求回答问题:| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |
科目:gzhx 来源: 题型:
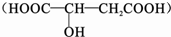 苹果酸如图所示,常用做汽水、糖果的添加剂.写出苹果酸分别与下列物质反应的化学方程式:(1)Na
苹果酸如图所示,常用做汽水、糖果的添加剂.写出苹果酸分别与下列物质反应的化学方程式:(1)Na

 C2H5OOCCH(OH)CH2COOC2H5+2H2O
C2H5OOCCH(OH)CH2COOC2H5+2H2O C2H5OOCCH(OH)CH2COOC2H5+2H2O
C2H5OOCCH(OH)CH2COOC2H5+2H2O科目:gzhx 来源: 题型:阅读理解
| 试剂组合序号 | 固体试剂(g) | NH3体积(mL) | |
| a | 12.0g Ca(OH)2 (过量) | 10.8g NH4Cl | 2688 |
| b | 10.8g (NH4)2SO4 | 2728 | |
| c | 12.0g NaOH (过量) | 10.8g NH4Cl | 3136 |
| d | 10.8g (NH4)2SO4 | 3118 | |
| e | 12.0g CaO (过量) | 10.8g NH4Cl | 3506 |
| f | 10.8g (NH4)2SO4 | 3584 | |
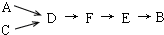
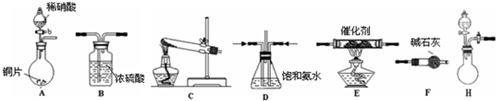
科目:gzhx 来源: 题型:
 A~J分别表示中学化学中常见的一种物质,它们之间相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素.请填写下列空白:
A~J分别表示中学化学中常见的一种物质,它们之间相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素.请填写下列空白:
| ||
| ||
科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:
| O | 2- 3 |
| O | - 4 |
| O | - 2 |
| C | ||
|
科目:gzhx 来源: 题型:
 2NH3(g)△H=-92.2kJ/mol
2NH3(g)△H=-92.2kJ/mol 2NH3(g)△H=-92.2kJ/mol
2NH3(g)△H=-92.2kJ/mol
| ||
| ||
科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:
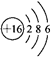

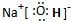
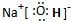
 HClO+OH-
HClO+OH- HClO+OH-
HClO+OH-科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:
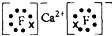
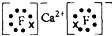
科目:gzhx 来源: 题型:

科目:gzhx 来源: 题型: