
科目:gzhx 来源: 题型:阅读理解
 接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:
接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:| 压强转化率温度 | 0.1MPa | 0.5MPa | 1MPa | 10MPa |
| 400℃ | 99.2% | 99.6% | 99.7% | 99.9% |
| 500℃ | 93.5% | 96.9% | 97.8% | 99.3% |
| 600℃ | 73.7% | 85.8% | 89.5% | 96.4% |
科目:gzhx 来源: 题型:
 在一定条件下可用SnO2/Al2O3等多种催化剂实现丙烯选择性还原NOx,
在一定条件下可用SnO2/Al2O3等多种催化剂实现丙烯选择性还原NOx,科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:
四个体积相同的密闭容器中在一定的条件下发生反应:2SO2+O2
|
科目:gzhx 来源: 题型:

科目:gzhx 来源: 题型:
| ||
| ||
| CuCl2 | ||
|
| CuCl2 | ||
|
科目:gzhx 来源: 题型:
| A、甲、乙、丙、丁 | B、乙、甲、丙、丁 | C、乙、甲、丁、丙 | D、丁、丙、乙、甲 |
科目:gzhx 来源: 题型:
| [SO3] |
| [SO2]2[O2] |
| [SO3] |
| [SO2]2[O2] |
科目:gzhx 来源: 题型:
| ||
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
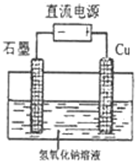
| ||
| 光照 |
| Cu2O |
| 序号 | t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| C/mol-1 | |||||||
| 温度/℃ | |||||||
| ① | T1 | 0.500 | 0.492 | 0.486 | 0.482 | 0.480 | 0.480 |
| ② | T1 | 0.500 | 0.488 | 0.484 | 0.480 | 0.480 | 0.480 |
| ③ | T2 | 0.500 | 0.450 | 0.450 | 0.450 | 0.450 | 0.450 |
科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:阅读理解
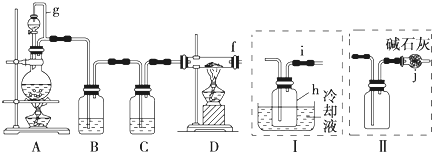
| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | 12.8 | - | 315 | - |
| 熔点/℃ | -70.0 | -107.2 | - | - | - |
| 升华温 度/℃ |
- | - | 180 | 300 | 162 |
| 方案 | 优点 | 缺点 |
| 甲 | ①收集产品的导管粗,不会堵塞导管 ②冷凝产品,减少产品损失 ①收集产品的导管粗,不会堵塞导管 ②冷凝产品,减少产品损失 |
①空气中的水蒸气进入产品收集装置,使四氯化硅水解 ②尾气没有处理,污染环境 ①空气中的水蒸气进入产品收集装置,使四氯化硅水解 ②尾气没有处理,污染环境 |
| 乙 | ①有尾气处理装置,注重环保 ②避免空气中的水蒸气进入装置 ①有尾气处理装置,注重环保 ②避免空气中的水蒸气进入装置 |
①产品易堵塞导管 ②没有冷凝装置,产品易损失 ①产品易堵塞导管 ②没有冷凝装置,产品易损失 |
| ||
| ||
科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:
 接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:
接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:科目:gzhx 来源: 题型:
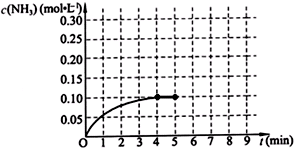 (2013•广东模拟)在一固定容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)⇌2NH3(g)△H<0.反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
(2013•广东模拟)在一固定容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)⇌2NH3(g)△H<0.反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题: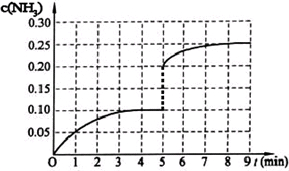

科目:gzhx 来源: 题型:
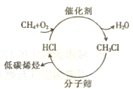 随着石油资源的日趋紧张,天然气资源的转化利用越来越受到人们的关注.如图所示是最近研发出的天然气利用新途径:首先,甲烷在催化剂作用下发生“氧氯化反应”生成一氯甲烷;然后,一氯甲烷在400℃的条件下通过分子筛催化转化为低碳烯烃.
随着石油资源的日趋紧张,天然气资源的转化利用越来越受到人们的关注.如图所示是最近研发出的天然气利用新途径:首先,甲烷在催化剂作用下发生“氧氯化反应”生成一氯甲烷;然后,一氯甲烷在400℃的条件下通过分子筛催化转化为低碳烯烃.| 分子筛 |
| 分子筛 |
科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型: