
科目:gzhx 来源: 题型:
| ||
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
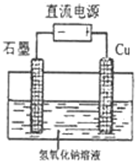
| ||
| 光照 |
| Cu2O |
| 序号 | t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| C/mol-1 | |||||||
| 温度/℃ | |||||||
| ① | T1 | 0.500 | 0.492 | 0.486 | 0.482 | 0.480 | 0.480 |
| ② | T1 | 0.500 | 0.488 | 0.484 | 0.480 | 0.480 | 0.480 |
| ③ | T2 | 0.500 | 0.450 | 0.450 | 0.450 | 0.450 | 0.450 |
科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:
| 时间/min | n(CO)/mol | n(H2O)/mol | n(CO2)/mol | n(H2)/mol |
| 0 | 1 | 4 | 0 | 0 |
| 4 | 0.25 | 3.25 | 0.75 | 0.75 |
| 6 | n1 | n2 | n3 | n4 |
| 8 | n1 | n2 | n3 | n4 |
| t | 0.15 | 3.15 | 0.85 | 0.85 |
| A、前4min,用CO表示的化学反应速率为v(CO)=0.25mol/(L•min) |
| B、反应在第4min时处于化学平衡状态 |
| C、8分钟时,混合气体中CO2的体积分数为16% |
| D、t分钟时,反应所处的温度高于850℃ |
科目:gzhx 来源: 题型:
. |
| v |
科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:阅读理解
| 时间(min) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| SO2 | 10 | 7 | 5 | 3.5 | 2 | 1 | 1 | 1 |
| O2 | 5 | 3.5 | 2.5 | 1.75 | 1 | 0.5 | 0.5 | 0.5 |
| SO3 | 0 | 3 | 5 | 6.5 | 8 | 9 | 9 | 9 |
| 压强/MPa 温度/℃ |
0.1 | 0.5 | 1 | 10 |
| 400 | 99.2% | 99.6% | 99.7% | 99.9% |
| 500 | 93.5% | 96.9% | 97.8% | 99.3% |
| 600 | 73.7% | 85.8% | 89.5% | 96.4% |
科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:
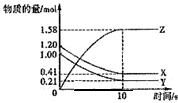 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示,下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示,下列描述正确的是( )| A、反应开始到10s,用Z表示的反应速率为0.158moL/(L•s) | B、l0s后,该反应停止进行 | C、反应的化学方程式为:X(g)+Y(g)⇌2Z(g) | D、反应开始到l0s时,平均反应速率ν(X)=ν(Y)=0.0395mol/(L•s) |
科目:gzhx 来源: 题型:
. |
| v |
科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:
| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
| n(O2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.10 | 0.10 |
科目:gzhx 来源: 题型:
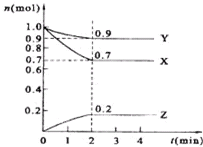 某温度时,在2L的密闭容器中,X、Y、Z的物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z的物质的量随时间的变化曲线如图所示.科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:
| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
| A | B | C | D | |
| n(CO2) | 3 | 1 | 0 | 1 |
| n(H2) | 2 | 1 | 0 | 1 |
| n(CO) | 1 | 2 | 3 | 0.5 |
| n(H2O) | 5 | 2 | 3 | 2 |
科目:gzhx 来源: 题型: