
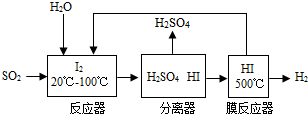
科目:gzhx 来源:2016届福建省高一上学期第二次月考化学试卷(解析版) 题型:实验题
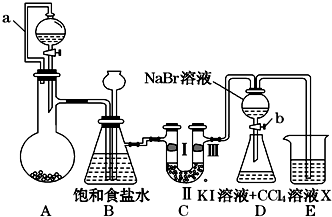
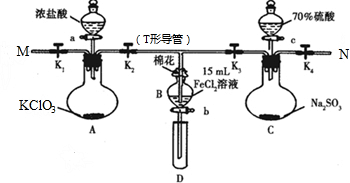
(13分)下图是某同学设计的制备少量氯气并进行系列实验的装置(夹持及加热仪器已略)。

⑴若装置A中制备氯气选用的药品为固体二氧化锰和浓盐酸,请写出装置A中的化学反应方程式: ;
实验室也可用高锰酸钾制氯气:2KMnO4+16HCl(浓) =5Cl2↑+2MnCl2 +2KCl+8H2O
该反应中的氧化剂是 ,若消耗0.2 mol氧化剂,则被氧化的还原剂的物质的量是 mol;
⑵装置B中饱和食盐水的作用是 ;
⑶装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入_______(填编号);(碱石灰为NaOH与CaO混合物,无水氯化钙为中性干燥剂)
| a | b | c | d |
I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
II | 碱石灰 | 无水氯化钙 | 碱石灰 | 无水氯化钙 |
III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
⑷设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱。当向D中缓缓通入少量氯气时,可以看到D中无色溶液逐渐变为________色,若打开D装置的活塞,使D中溶液滴入E装置(KI溶液与CCl4),振荡锥形瓶后静置一会儿,可以观察到的现象是 ;
⑸装置F中用足量的NaOH溶液吸收余氯,试写出相应的化学方程式 。
科目:gzhx 来源: 题型:解答题

| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 碱石灰 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
科目:gzhx 来源: 题型:解答题

| a | b | c | d | |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| II | 碱石灰 | 无水氯化钙 | 碱石灰 | 无水氯化钙 |
| III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
科目:gzhx 来源:2015-2016学年福建省宁德市高二下期末化学试卷(解析版) 题型:实验题
某化学兴趣小组为探究氯气的性质并用Cl2制备HClO,设计如下实验方案,请回答下列问题:
实验一:性质探究
设计图3实验装置来制备并验证氯气的性质,部分夹持设计未画出。

图3
(1)请写出装置A中制备氯气的反应化学方程式______________________;
(2)装置B的作用是______________________;
(3)双通管C中事先装有两个沾有相关试剂的棉球,实验现象为_____________;
实验二:制备HClO
(4)设计图4所示装置E代替图3中的装置C,用于制备较高浓度的HClO溶液。在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙。


图4
①该方案反应后所得的溶液中HClO浓度比氯水中大的原因是_______________
②反应结束后将塑料网中剩余的石灰石提出液面,所得的溶液与稀盐酸混合,立即产生大量CO2气体,则反应所得溶液中的溶质除CaCl2、HClO外,还含有__________
③该小组同学测得反应中碳酸钙质量减少a g,反应后从所得的100mL溶液中取用10mL与稀盐酸混合,连接F装置测得产生的气体体积为b L(已换算成标准状况),则原溶液中CaCl2的浓度为 mol·L-1(用含a、b的代数式表示,可不必化简)。
科目:gzhx 来源: 题型:
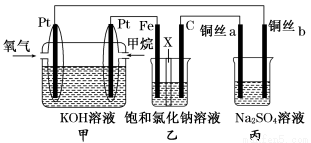
 如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为阳离子交换膜,丙中滴有少量的酚酞试液.请按要求回答相关问题:
如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为阳离子交换膜,丙中滴有少量的酚酞试液.请按要求回答相关问题:科目:gzhx 来源: 题型:解答题
 某同学设计如图所示的实验方案:
某同学设计如图所示的实验方案:| ① | ② | ③ | ④ | |
| Ⅰ | 湿润的红纸条 | 干燥的红纸条 | 干燥的红纸条 | 湿润的红纸条 |
| Ⅱ | 碱石灰 | 浓硫酸 | 硅胶 | 氯化钠 |
| Ⅲ | 湿润的红纸条 | 干燥的红纸条 | 干燥的白纸条 | 干燥的红纸条 |
科目:gzhx 来源: 题型:实验题

| ① | ② | ③ | ④ | |
| Ⅰ | 湿润的红纸条 | 干燥的红纸条 | 干燥的红纸条 | 湿润的红纸条 |
| Ⅱ | 碱石灰 | 浓硫酸 | 硅胶 | 氯化钠 |
| Ⅲ | 湿润的红纸条 | 干燥的红纸条 | 干燥的白纸条 | 干燥的红纸条 |
科目:gzhx 来源:2015届山东省高三第一次学情调查化学试卷(解析版) 题型:填空题
(14分)如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为阳离子交换膜,丙中滴有少量的酚酞试液。
请按要求回答相关问题:
(1)甲烷燃料电池负极电极反应式是: 。
(2)石墨电极(C)的电极反应式为______________________________。
(3)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁电极上生成的气体体积为___ L。
(4)铜丝a处在开始一段时间的现象为______________;原因是________________________________________________________________________。
(5)丙中以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是________。
a.电能全部转化为化学能
b.粗铜接电源正极, 发生氧化反应
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
(6)利用反应2Cu+O2+2H2SO4===2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应为____________________________。
科目:gzhx 来源: 题型:
下图是某兴趣小组在实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。

(1)实验室制备氯气的化学方程式为_____________________________________________,
该反应的氧化剂是____________。
(2)装置B中饱和食盐水的作用是______________________________________________;
同时装置B亦是安全瓶,监测实验进行时装置C是否发生堵塞,请写出发生堵塞时装置B中的现象:________________________________________________________________。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此装置C中Ⅰ、Ⅱ、Ⅲ处依次放入________(填“a”、“b”、“c”或“d”)。
| a | b | c | d | |
| Ⅰ | 干燥的有 色布条 | 干燥的有 色布条 | 湿润的有 色布条 | 湿润的有 色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有 色布条 | 湿润的有 色布条 | 干燥的有 色布条 | 干燥的有 色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性强弱。
向装置D中缓缓通入少量氯气时,可以看到________,说明氯的非金属性大于溴。打开活塞,将装置D中的少量溶液加入装置E中,振荡。观察到E中溶液分为两层,上层(苯层)为紫红色,说明溴的非金属性______碘。
(5)下列装置中可以代替装置F的是________。

科目:gzhx 来源:2017届江西省高三上学期10月月考化学试卷(解析版) 题型:实验题
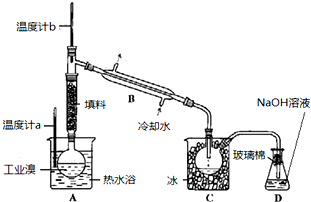
FeBr2是一种黄绿色固体,某学习小组制备并探究它的还原性
Ⅰ.实验室制备FeBr2
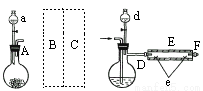
实验室用下图所示装置制取溴化亚铁.其中A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈钢管.e是两只耐高温的瓷皿,其中盛有细铁粉.
实验开始时先将铁粉加热至600℃~700℃,然后将干燥、纯净的CO2气流通入D中,E管中反应开始,不断将d中液溴滴入100℃~120℃的D中,经过几小时的连续反应,在铁管的一端沉积有黄绿色鳞片状溴化亚铁
请回答:
(1)如何检查用塞子(插有导管和仪器)塞紧的D的气密性_____________.
(2)若在A中盛固体CaCO3,a中盛6mol/L盐酸,为使导入D中的CO2为干燥纯净的气体,则图中B、C处的装置和其中的试剂应是:B为________,C为________.为防止污染空气,实验时应在F处连接盛________的尾气吸收装置
(3)反应过程中要不断通入CO2,其主要作用是①________,②________.
Ⅱ.探究FeBr2的还原性,
(1)实验需要90 mL 0.1 mol·L-1FeBr2溶液,配制FeBr2溶液除烧杯、量筒、胶头滴管、玻璃棒外还需的玻璃仪器是_____________。
(2)取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br- 被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+ 被Cl2氧化成Fe3+。
设计实验证明假设2是正确的
(3)实验证明:还原性Fe2+ > Br-请用一个离子方程式来证明: ;
(4)若在40mL上述FeBr2溶液中通入3×10-3molCl2,则反应的离子方程式为: 。
科目:czhx 来源: 题型:
| ||
| ||
科目:gzhx 来源: 题型:阅读理解

| 溴 | 物理性质 | 暗红色液体,刺激性气味.室温下易挥发.熔点-7.2℃,沸点59.1℃.密度2.928g・cm-3.稍溶于冷水. |
| 化学性质 | 溶于水生成次溴酸 |
科目:czhx 来源:2013年初中毕业升学考试(山东济宁卷)化学(解析版) 题型:简答题
⑴实验室中,我们通常使用下面三种方法来制取氧气;
2H2O2 2H2O+O2↑
2H2O+O2↑
2KClO3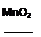 2KCl+3O2↑
2KCl+3O2↑
2KMnO4 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
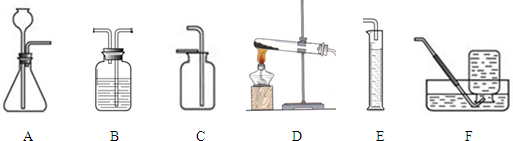
下图是气体制备时的常用装置:
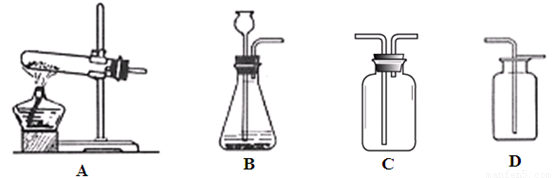
根据你对上述内容的理解,回答下列问题:
①装置C的名称是 ;
②一般采用双氧水制取氧气的理由是 ;
③采用高锰酸钾制氧气选用的发生装置是 ;
④采用氯酸钾制得的氧气有刺激性气味,是因为氯酸钾分解时会产生少量的氯气。可利用 (填序号)装置,并向其中加入 溶液除去;
⑤三种制氧方法中都出现二氧化锰,他们的作用有何不同?
信息提供:
氯气有毒,会对上呼吸道黏膜造成伤害,症状严重时会致人死亡,少量氯气可通过碱溶液除去。
⑵苏打水是碳酸氢钠(NaHCO3)的水溶液,有弱碱性。医学上外用可消毒杀菌,饮用可改变酸性体质,保持人体内的酸碱平衡。下图是某品牌苏打水的图片和配料表,读图完成下面问题:

①根据配料表可以发现:苏打水成分中的无机物有 ,有机物有 (每空至少填写两种物质);
②请你设计实验证明该品牌苏打水含有碳酸氢钠:
|
实验步骤 |
实验现象 |
实验结论及化学反应方程式 |
|
|
|
|
科目:czhx 来源: 题型:问答题
⑴实验室中,我们通常使用下面三种方法来制取氧气;
2H2O2 2H2O+O2↑
2H2O+O2↑
2KClO3 2KCl+3O2↑
2KCl+3O2↑
2KMnO4 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
下图是气体制备时的常用装置: 
根据你对上述内容的理解,回答下列问题:
①装置C的名称是 ;
②一般采用双氧水制取氧气的理由是 ;
③采用高锰酸钾制氧气选用的发生装置是 ;
④采用氯酸钾制得的氧气有刺激性气味,是因为氯酸钾分解时会产生少量的氯气。可利用 (填序号)装置,并向其中加入 溶液除去;
⑤三种制氧方法中都出现二氧化锰,他们的作用有何不同?
信息提供:
氯气有毒,会对上呼吸道黏膜造成伤害,症状严重时会致人死亡,少量氯气可通过碱溶液除去。
⑵苏打水是碳酸氢钠(NaHCO3)的水溶液,有弱碱性。医学上外用可消毒杀菌,饮用可改变酸性体质,保持人体内的酸碱平衡。下图是某品牌苏打水的图片和配料表,读图完成下面问题:
①根据配料表可以发现:苏打水成分中的无机物有 ,有机物有 (每空至少填写两种物质);
②请你设计实验证明该品牌苏打水含有碳酸氢钠:
| 实验步骤 | 实验现象 | 实验结论及化学反应方程式 |
| | | |
科目:czhx 来源:不详 题型:问答题
 2H2O+O2↑
2H2O+O2↑ 2KCl+3O2↑
2KCl+3O2↑ K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑

| 实验步骤 | 实验现象 | 实验结论及化学反应方程式 |
| | | |
科目:gzhx 来源: 题型:解答题
科目:czhx 来源: 题型:
| 实验序号 | KClO3 质量 | 加入其它的物质 | 待测数据 |
| l | 1.2g | 无其它物质 | 收集40mL氧气所需时间 收集40mL氧气所需时间 |
| 2 | 1.2g | 加入少量的CuO | 收集40mL氧气所需时间 收集40mL氧气所需时间 |
科目:gzhx 来源: 题型:
 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:CH3CH-CH2+CO+H2
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:CH3CH-CH2+CO+H2| 一定条件 |
| H2 |
| Ni,△ |
| 浓H2SO4 |
| △ |
科目:czhx 来源:2008-2009学年第二学期扬州市联谊学校三月考初三化学试题 题型:058
某同学利用化工厂的废碱液(主要成分为Na2CO3,还含有少量NaCl,其它杂质不计)和石灰乳为原料制备烧碱,并对所得的烧碱粗产品的成分进行分析和测定.
[粗产品制备](1)将废碱液加热蒸发浓缩,形成较浓的溶液,冷却后与石灰乳混合,发生反应的化学方程式为________.
(2)将反应后的混合物过滤,得到的滤液进行蒸发结晶,制得NaOH粗产品.
[粗产品成分分析](1)取适量粗产品溶于水,滴加Ba(NO3)2溶液出现白色浑浊,发生反应的化学方程式为________,该粗产品中一定不含有________,理由是________.
(2)该小组同学通过对粗产品成分的实验分析,确定该粗产品中含有三种物质.
[粗产品含量测定]Na2CO3含量的测定:
(1)该兴趣小组的同学设计了下图所示的实验装置.取10.0 g粗产品,进行实验.
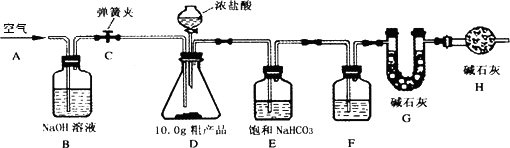
[说明]碱石灰是CaO与NaOH的固体混合物.E装置中的饱和NaHCO3溶液是为了除去二氧化碳气体中的氯化氢,发生的反应为NaHCO3+HC1=NaCl十CO2↑十H2O.
(2)操作步骤
①连接好装置,检查气密性;②打开弹簧夹C,在A处缓缓通入一段时间空气;③称量G的质量;④关闭弹簧夹C,慢慢滴加浓盐酸至过量,直至D中无气泡冒出;⑤打开弹簧夹C,再次缓缓通入一段时间空气;⑥再次称量G的质量,得前后两次质量差为0.48 g.
(3)问题探究 F中的试剂应为________,B装置的作用是________,H装置的作用是________.
若没有H装置,则测定的Na2CO3的质量分数会________(填“偏大”、“偏小”、“不变”).事实上10.0 g粗产品只能产生0.44 g CO2.请你仔细分析上述实验,解释实验值0.48 g比正确值0.44 g偏大的原因(假设操作均正确)________
(4)数据计算
根据正确值0.44 g可求得粗产品中Na2CO3的质量分数为________%.
NaOH含量的测定:该小组同学又另取10.0 g粗产品,逐滴加入20%的盐酸至恰好完全反应时,消耗盐酸的质量为36.5 g.放出CO2 0.44 g(不考虑二氧化碳气体的溶解).求原粗产品中NaOH的质量分数.(写出计算过程)
科目:gzhx 来源: 题型:
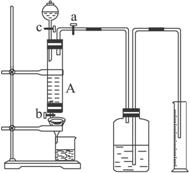
完成下列问题:
(1)如何检查装置A的气密性:__________________。
(2)实验时打开a,关闭b,从分液漏斗内向A中加过量的稀盐酸,观察到的现象是__________________________;滴加盐酸时,发现反应速率较相同浓度盐酸与铁粉反应要快,其原因是________________________________________________________________。
(3)待A中的物质反应完成后,打开b,进行过滤,滤液过滤到盛有过氧化氢的烧杯中,发生反应的化学方程式为:________________________________。
(4)要从烧杯内溶液得到FeCl3·6H2O晶体,主要操作包括:_________________________________________________。
(5)实验室若没有过氧化氢,可用下列 _________试剂代替(填选项)。
A.过量稀硝酸 B.过量氯水 C.过量氨水 D.过量氢氧化钠溶液
(6)若要测废铁屑中铁的纯度,测出放出气体的体积V(已折算成标准状况,单位:L),则废铁屑的纯度为 _________(用m、V的代数式表示)。