
科目:gzhx 来源: 题型:
科目:gzhx 来源:不详 题型:问答题
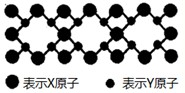
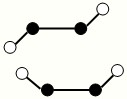
科目:gzhx 来源:2011年福建省泉州市晋江市季延中学高考化学模拟试卷(八)(解析版) 题型:解答题
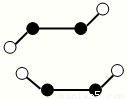
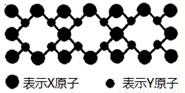
科目:gzhx 来源: 题型:
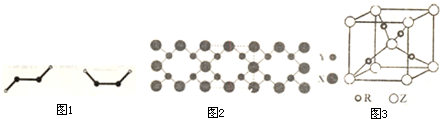
科目:gzhx 来源:2013-2014学年湖北省武汉市高三二月调研测试理科综合化学试卷(解析版) 题型:填空题
已知X,Y,Z,Q为短周期非金属元素,R是长周期元素,X原子的电子占据2个电子层且原子中成对电子数是未成对电子数的2倍;Y的基态原子有7种不同运动状态的电子;Z元素在地壳中含量最多;Q是电负性最大的元素;R+离子只有三个电子层且完全充满电子。
回答下列问题:(答题时,X、Y、Z、Q、R用所对应的元素符号表示)
(1)X元素为 ,X、Y、Z中第一电离能最大的是 。
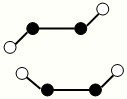
(2)已知Y2Q2分子存在如图所示的两种结构(球棍模型,短线不一定代表单键):


该分子中Y原子的杂化方式是 。
(3)X与Y元素可以形成一种超硬新材料,其晶体部分结构如图所示,有关该晶体的说法正确的是 (填正确答案编号)。

A.该晶体属于分子晶体
B.此晶体的硬度比金刚石还大
C.晶体的化学式是X3Y4
D.晶体熔化时破坏共价键
(4)有一种AB型分子与Y单质分子互为等电子体,它是一种常用的还原剂,其化学式为 。
(5)R的基态原子的电子排布式为 ,R与Z形成的某离子晶体的晶胞结构如图,则该晶体的化学式为 ,该晶体的密度为a g·cm-3,则晶胞的体积是 cm3。
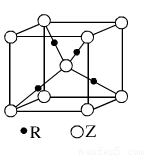
科目:gzhx 来源:不详 题型:填空题



| A.该晶体属于分子晶体 |
| B.此晶体的硬度比金刚石还大 |
| C.晶体的化学式是X3Y4 |
| D.晶体熔化时破坏共价键 |

科目:gzhx 来源:2016届广西河池市高三上第五次月考理综化学试卷(解析版) 题型:填空题
已知X、Y、Z、Q为短周期非金属元素,R是长周期元素,X原子的电子占据2个电子层且原子中成对电子数是未成对电子数的2倍;Y的基态原子有7种不同运动状态的电子;Z元素在地壳中含量最多;Q是电负性最大的元素;R+离子只有三个电子层且完全充满电子。
回答下列问题:(答题时,X、Y、Z、Q、R用所对应的元素符号表示)
(1)X元素为 ,X、Y、Z中第一电离能最大的是 。
(2)已知Y2Q2分子存在如图所示的两种结构(球棍模型,短线不一定代表单键):
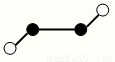

该分子中Y原子的杂化方式是 。
(3)X与Y元素可以形成一种超硬新材料,其晶体部分结构如下图所示,有关该晶体的说法正确的是 (填写字母序号)。

A.该晶体属于分子晶体 B.此晶体的硬度比金刚石还大
C.晶体的化学式是X3Y4 D.晶体熔化时破坏共价键
(4)有一种AB型分子与Y单质分子互为等电子体,它是一种常用的还原剂,其化学式为 。
(5)R的基态原子的电子排布式为 ,R与Z形成的某离子晶体的晶胞结构如下图,则该晶体的化学式为 ,该晶体的密度为a g·cm-3,则晶胞的体积是 cm3(用含a、NA的代数式表示)。
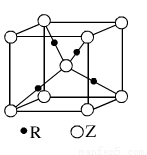
科目:gzhx 来源: 题型:解答题

 ,有关该晶体的说法正确的是
,有关该晶体的说法正确的是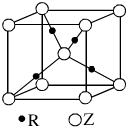
科目:gzhx 来源: 题型:
 (2010•龙岩模拟)X、Y、Z、Q为短周期非金属元素,R是长周期元素.X原子的电子占据2个电子层且原子中成对电子数是未成对电子数的2倍;Y的基态原子有7种不同运动状态的电子;Z元素在地壳中含量最多;Q是电负性最大的元素;R+离子只有三个电子层且完全充满电子.
(2010•龙岩模拟)X、Y、Z、Q为短周期非金属元素,R是长周期元素.X原子的电子占据2个电子层且原子中成对电子数是未成对电子数的2倍;Y的基态原子有7种不同运动状态的电子;Z元素在地壳中含量最多;Q是电负性最大的元素;R+离子只有三个电子层且完全充满电子.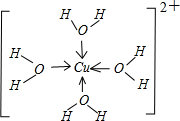

 A.该晶体属于分子晶体
A.该晶体属于分子晶体科目:gzhx 来源:2013-2014江西省上饶市第二学期期末教学质量测试高二化学试卷(解析版) 题型:填空题
[化学———物质结构与性质]
已知X,Y,Z,Q为短周期非金属元素,R是长周期元素,X原子的电子占据2个电子层且原子中成对电子数是未成对电子数的2倍;Y的基态原子有7种不同运动状态的电子;Z元素在地壳中含量最多;Q是电负性最大的元素;R+离子只有三个电子层且完全充满电子。
回答下列问题:(答题时,X、Y、Z、Q、R用所对应的元素符号表示)
(1)X元素为 ,X、Y、Z中第一电离能最大的是 。
(2)已知Y2Q2分子存在如图所示的两种结构(球棍模型,短线不一定代表单键):

该分子中Y原子的杂化方式是 。
(3)X与Y元素可以形成一种超硬新材料,其晶体部分结构如图所示,有关该晶体的说法
正确的是 (填正确答案编号)。

A.该晶体属于分子晶体 B.此晶体的硬度比金刚石还大
C.晶体的化学式是X3Y4 D.晶体熔化时破坏共价键
(4)有一种AB型分子与Y单质分子互为等电子体,它是一种常用的还原剂,其化学式为 。
(5)R的基态原子的电子排布式为 ,R与Z形成的某离子晶体的晶胞结构如图,则该晶体的化学式为 ,该晶体的密度为a g·cm-3,则晶胞的体积是  。
。

科目:gzhx 来源: 题型:
 A,B,C,D,E,F都是短周期元素,原子序数依次增大,B,C同周期且相邻,A,D同主
A,B,C,D,E,F都是短周期元素,原子序数依次增大,B,C同周期且相邻,A,D同主x- 6 |
 表示)位于该正方体的顶点和面心.该化合物的化学式是
表示)位于该正方体的顶点和面心.该化合物的化学式是科目:gzhx 来源: 题型:解答题
 .
. (用相关的化学用语作答).
(用相关的化学用语作答).| 元素 | Mn | Fe |
| 电离能 | ||
| (kJ•mol-1) | ||
| I1 | 717 | 759 |
| I2 | 1 509 | 1561 |
| I3 | 3 248 | 2 957 |

科目:gzhx 来源:2016届河北正定中学高三上学期第五次月考理科综合化学试卷(解析版) 题型:填空题
过渡金属元素及其化合物的应用广泛,是科学家们进行前沿研究的方向之一。
(1)测定土壤中铁的含量时需先将三价铁还原为二价铁,再采用邻啡罗啉做显色剂,用比色法测定,若土壤中含有高氯酸盐时会对测定有干扰。相关的反应如下:
4FeCl3+2NH2OH•HCl=4FeCl2+N2O↑+6HCl+H2O
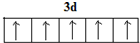
①基态Fe原子中,电子占有的最高能层符号为__________,核外未成对电子数为__________,Fe3+在基态时,外围电子排布图为______________________________。
②羟胺中(NH2OH)采用sp3杂化的原子有_______________,三种元素电负性由大到小的顺序为________;与ClO4-互为等电子体的分子的化学式为_______________________。
(2) 过渡金属原子可以与CO分子形成配合物,配合物价电子总数符合18电子规则。如Cr可以与CO形成Cr(CO)6分子:价电子总数(18)=Cr的价电子数(6)+CO提供电子数(2×6)。Fe、Ni两种原子都能与CO形成配合物,其化学式分别为_____________、______________。
(3) Pt2+的常见配合物Pt(NH3)2Cl2存在 两种不同的结构:一种为淡黄色(Q),不具有抗癌作用,在水中的溶解度较小;另一种为黄绿色(P),具有抗癌作用,在水中的溶解度较大。
两种不同的结构:一种为淡黄色(Q),不具有抗癌作用,在水中的溶解度较小;另一种为黄绿色(P),具有抗癌作用,在水中的溶解度较大。
①Q是_________________分子(选填“极性”或“非极性”)。
②P分子的结构简式为__________________________。
(4)NiXO晶体晶胞结构为NaCl型,由于晶体缺陷,x值为0.88,晶胞边长为a pm。晶胞中两个Ni原子之间的最短距离为___________pm。若晶体中的Ni分别为Ni2+、Ni3+,此晶体中Ni2﹢与Ni3﹢的最简整数比为_________。
科目:gzhx 来源: 题型:解答题
 .
.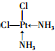 .
.科目:gzhx 来源: 题型:填空题
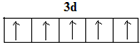 .
. .
.科目:gzhx 来源:2013-2014湖南省长沙市高三高考二模理综化学试卷(解析版) 题型:填空题
【化学——选修3:物质结构与性质】(15分)
(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6] (NO3)3 [三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等。
①基态Fe3+的M层电子排布式为 。
②配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x= 。 Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于 (填晶体类型);
(2)O和Na形成的一种只含有离子键的离子化合物的晶胞结构如右图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为 。已知该晶胞的密度为ρ g/cm3,阿伏加德罗常数为NA,求晶胞边长 a = cm。 (用含ρ、NA的计算式表示)
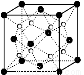
(3)下列有关的说法正确的是 。
A.第一电离能大小:S>P>Si
B.电负性顺序:C<N<O<F
C.因为晶格能CaO比KCl高,所以KCl比CaO熔点低
D.SO2与CO2的化学性质类似,分子结构也都呈直线型,相同条件下SO2的溶解度更大
E.分子晶体中,共价键键能越大,该分子晶体的熔沸点越高
(4)原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种类最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29。回答下列问题:
① Y2X2分子中Y原子轨道的杂化类型为 ,1mol Y2X2含有σ键的数目为
。
② 化合物ZX3的沸点比化合物YX4的高,其主要原因是 。
③ 元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是 。
科目:gzhx 来源:不详 题型:填空题
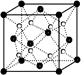
| A.第一电离能大小:S>P>Si |
| B.电负性顺序:C<N<O<F |
| C.因为晶格能CaO比KCl高,所以KCl比CaO熔点低 |
| D.SO2与CO2的化学性质类似,分子结构也都呈直线型,相同条件下SO2的溶解度更大 |
科目:gzhx 来源: 题型:
 (1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等.
(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等.科目:gzhx 来源:2014-2015学年四川省高三上学期期中考试化学试卷(解析版) 题型:填空题
(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等。
①基态Fe3+的M层电子排布式为 。
②配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x= 。Fe(CO)x常温下呈液态,熔点为 -20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于 (填晶体类型)。
(2)O和Na形成的一种只含有离子键的离子化合物的晶胞结构如图,距一个阴离子最近的所有阳离子为顶点构成的几何体为 。已知该晶胞的密度为ρg/cm3,阿伏加德罗常数为NA,求晶胞边长a= cm。(用含ρ、NA的计算式表示)

(3)原子序数小于36的X、Y、Z、M、W五种元素,其中X是原子半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,M基态原子中s电子数等于p电子数。W的原子序数为29。回答下列问题:
①Y2X2分子中Y原子轨道的杂化类型为 ,空间构型 。
②基态W原子的核外电子排布式 。
③Y、Z、M三种元素的第一电离能由大到小的顺序为 (用元素符号表示)化合物ZX3的沸点比化合物YX4的高,其主要原因是 。
④元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是 。
⑤YM、ZM混合气体污染的处理方法之一是将其在催化剂作用下转化为Z的单质。
已知::①YM(g)+ 1/2M2(g)=YM2(g) △H=-283.0kJ·mol-1
②Z2(g)+ M2(g)=2ZM(g) △H=+180.5kJ·mol-1
则上述反应的热化学方程式是 。
科目:gzhx 来源: 题型:
(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6] (NO3)3 [三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等。
①基态Fe3+的M层电子排布式为 。
②配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x= 。 Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于 (填晶体类型);
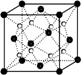 (2)O和Na形成的一种只含有离子键的离子化合物的晶胞结构如右图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为 。已知该晶胞的密度为ρ g/cm3,阿伏加德罗常数为NA,求晶胞边长 a = cm。 (用含ρ、NA的计算式表示)
(2)O和Na形成的一种只含有离子键的离子化合物的晶胞结构如右图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为 。已知该晶胞的密度为ρ g/cm3,阿伏加德罗常数为NA,求晶胞边长 a = cm。 (用含ρ、NA的计算式表示)
(3)下列有关的说法正确的是 。
A.第一电离能大小:S>P>Si
B.电负性顺序:C<N<O<F
C.因为晶格能CaO比KCl高,所以KCl比CaO熔点低
D.SO2与CO2的化学性质类似,分子结构也都呈直线型,相同条件下SO2的溶解度更大
E.分子晶体中,共价键键能越大,该分子晶体的熔沸点越高
(4)原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种类最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29。回答下列问题:
① Y2X2分子中Y原子轨道的杂化类型为 ,1mol Y2X2含有σ键的数目为
。
② 化合物ZX3的沸点比化合物YX4的高,其主要原因是 。
③ 元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是 。