d能与新制的cu(oh)2发生反应.该反应的化学方程式为答案解析
科目:gzhx
来源:
题型:解答题
15.烃A是一种重要的基本化工原料,用质谱法测得其相对分子质量为28.题10图是以A为原料合成药物中间体E和树脂K的路线
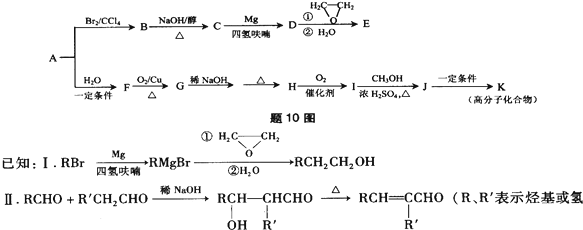
(1)A中官能团的结构简式是
.
(2)B→C的化学方程式为BrCH
2CH
2Br+NaOH$→_{△}^{醇}$CH
2=CHBr+NaBr+H
2O.
(3)E的分子式为C
4H
8O.下列关于E的说法正确的是ac(填字母序号).(R,R′表示烃基或氢原子)
a.能与金属钠反应b.分子中4个碳原子一定共平面
c.一定条件下,能与浓氢溴酸反应d.与CH
2CHCH
2OCH
2CH
3互为同系物
(4)写出符合下列条件的E的一种同分异构体:(CH
3)
2CHCHO.
a.该有机物能与新制的Cu(OH)
2发生反应;b.核磁共振氢谱有3组峰,其比值为6:1:1
(5)G→H涉及到的反应类型有加成反应、消去反应.
(6)I的分子式为C
4H
6O
2,其结构简式为CH
3CH=CHCOOH.
(7)J→K的化学方程式为

.
查看答案和解析>>
科目:gzhx
来源:期末题
题型:填空题
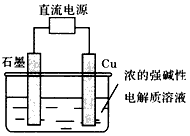
科学研究发现纳米级的Cu2O可作为太阳光分解水的催化剂。
I.四种制取Cu2O的方法
(a)用炭粉在高温条件下还原CuO制备Cu2O;
(b)用葡萄糖还原新制的Cu(OH)2制备Cu2O;
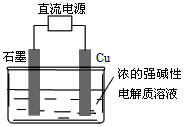
(c)电解法制备Cu2O。原理如图所示,则阳极电极反应可以表示为_________________;
(d)最新实验研究加热条件下用液态肼(N
2H
4)还原新制Cu(OH)
2可制备纳米级Cu
2O,同时放出N
2。该制法的化学方程式为___________________
Ⅱ.用制得的Cu
2O进行催化分解水的实验:
(1)一定温度下,在2L密闭容器中加入纳米级Cu
2O并通入0.10mol水蒸气,发生反应:
2H
2O(g)

2H
2(g)+O
2 (g) △H=+484kJ/mol 不同时段产生O
2的量见下表
前20min的反应速率v(H2O)=____________;该温度下,反应的平衡常数的表达式K=___________;达平衡时,至少需要吸收的光能为__________kJ。
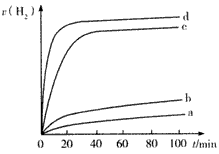
(2)用以上四种方法制得的Cu2O在某相同条件下分别对水催化分解,产生氢气的体积V(H2)随时间t变化如图所示。下列叙述正确的是________(填字母代号)。
A.c、d方法制得的Cu2O催化效率相对较高
B.d方法制得的Cu2O做催化剂时,水的平衡转化率最高
C.催化效果与Cu2O颗粒的粗细、表面活性等有关
D.Cu2O催化水分解时,需要适宜的温度
查看答案和解析>>
科目:gzhx
来源:模拟题
题型:推断题
科学研究发现纳米级的Cu
2O可作为太阳光分解水的催化剂。
I.四种制取Cu
2O的方法:
(1)火还原法:用炭粉在高温条件下还原CuO。
(2)用葡萄糖[CH
2OH(CHOH)
4CHO]还原新制的Cu(OH)
2,写出该反应的化学方程式:___。
(3)电解法:反应为2Cu +H
2O

Cu
2O+H
2↑,则阳极产物是___。
(4)最新研究表明用肼(N
2H
4)还原新制Cu(OH)
2可制备纳米级Cu
2O,同时放出N
2。该方法的化学方程式为___ 。
Ⅱ,用制得的Cu
2O进行催化分解水的实验。
(1)一定温度下,向2L密闭容器中加入纳米级Cu
2O并通入0.10 mol水蒸气,发生反应:
2H
2O(g)
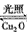
2H
2(g)+ O
2(g) △H=+484 kJ.mol
-1,不同时间内产生O
2的量如下表:
计算前20 min的反应速率v(H2O)=___;达到平衡时,至少需要吸收___kJ的光能。
(2)用以上四种方法制得的Cu2O在某相同条件下分别对水催化分解,产生氢气的速率(v)随时间(t)变化的关系如图所示,下列叙述正确的是___(填序号)。
A.c、d曲线对应方法制得的Cu2O的催化效率相对较高
B.d曲线对应方法制得的Cu2O作催化剂时,水的转化率最高
C.催化效果与Cu2O颗粒的粗细、表面活性等有关
D.Cu2O催化水分解时,需要适宜的温度
查看答案和解析>>
科目:gzhx
来源:0110 期末题
题型:实验题
科学研究发现纳米级的Cu2O可作为太阳光分解水的催化剂。
(1)四种制取Cu
2O的方法
(a)用炭粉在高温条件下还原CuO制备Cu
2O;
(b)用葡萄糖还原新制的Cu(OH)
2制备Cu
2O;
(c)电解法制备Cu
2O。原理如上图所示,则阳极电极反应可以表示为_____________________;
(d)最新实验研究加热条件下用液态肼(N
2H
4)还原新制Cu(OH)
2可制备纳米级Cu
2O,同时放出N
2。该制法的化学方程式为________________________。
(2)用制得的Cu
2O进行催化分解水的实验
①一定温度下,在2 L密闭容器中加入纳米级Cu
2O并通入0.10 mol水蒸气,发生反应:
2H
2O(g)

2H
2(g)+O
2(g) △H=+484 kJ/mol 不同时段产生O
2的量见下表
前20min的反应速率v(H2O) =_____________;该温度下,反应的平衡常数的表达式K=___________;达平衡时,至少需要吸收的光能为___________kJ。
②用以上四种方法制得的Cu2O在某相同条件下分别对水催化分解,产生氢气的体积V(H2)随时间t变化如图所示。下列叙述正确的是______________(填字母代号)。
A.c、d方法制得的Cu2O催化效率相对较高
B.d方法制得的Cu2O作催化剂时,水的平衡转化率最高
C.催化效果与Cu2O颗粒的粗细、表面活性等有关
D.Cu2O催化水分解时,需要适宜的温度
查看答案和解析>>
科目:gzhx
来源:
题型:
科学研究发现纳米级的Cu2O可作为太阳光分解水的催化剂。
Ⅰ.四种制取Cu2O的方法
(1)火法还原。用炭粉在高温条件下还原CuO;
(2)用葡萄糖[CH2OH(CHOH)4CHO]还原新制的Cu(OH)2。写出化学方程式 ;
(3)电解法。反应为2Cu + H2O  Cu2O + H2↑。则阳极产物是 ;
Cu2O + H2↑。则阳极产物是 ;
(4)最新实验研究用肼(N2H4)还原新制Cu(OH)2可制备纳米级Cu2O,同时放出N2。该制法的化学方程式为 。
Ⅱ.用制得的Cu2O进行催化分解水的实验
(1)一定温度下,在2L密闭容器中加入纳米级Cu2O并通入0.10mol水蒸气,发生反应:
时间/min | 20 | 40 | 60 | 80 |
n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |
2H2O(g) 2H2(g)+O2(g);△H = +484kJ・mol-1,不同时段产生O2的量见下表:
2H2(g)+O2(g);△H = +484kJ・mol-1,不同时段产生O2的量见下表:
计算:
前20min的反应速率 v(H2O)= ;该反应的平衡常数表达式K = ;达平衡时,至少需要吸收的光能为 kJ。
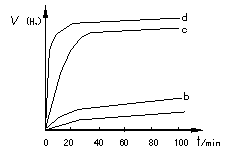
(2)用以上四种方法制得的Cu2O在某相同条件下分别对水催化分解,产生氢气的速率v随时间t变化如图所示。下列叙述正确的是 。
A.c、d方法制得的Cu2O催化效率相对较高
B.d方法制得的Cu2O作催化剂时,水的平衡转化率最高
C.催化效果与Cu2O颗粒的粗细、表面活性等有关
D.Cu2O催化水分解时,需要适宜的温度
查看答案和解析>>
科目:gzhx
来源:
题型:解答题
20.X是常温下的气态醛,A比X的相对分子质量大14,Y是最简单的芳香醛.现用X、Y、A制备有机物H,其合成路线如图:
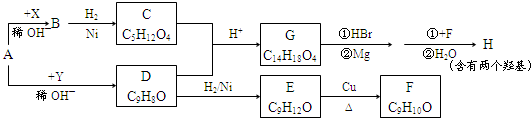
已知:①
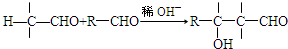
②
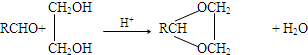
③
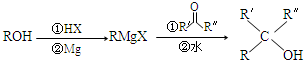
完成下列有关问题:
(1)X的名称:甲醛.
(2)C+D→G的化学方程式:

.X与苯酚生成高聚物反应的化学方程式
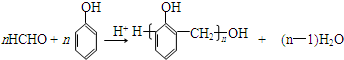
.
(3)H的结构简式是:
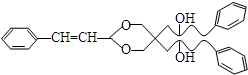
.
(4)C能发生的反应是ad.
a.取代反应 b.皂化反应 c.消去反应 d.置换反应 e.还原反应 f.加聚反应
(5)符合下列条件的C的同分异构体有3种
①属于直链化合物 ②与C具有相同的官能团 ③每个碳原子上最多只有一个官能团
(6)X与Y反应的生成物有多种同分异构体,写出能使FeCl
3溶液呈紫色,且其核磁共振谱上有五组峰,峰面积之比为1:2:2:2:1.则该同分异构体与新制Cu(OH)
2反应的方程式为
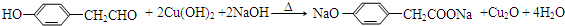
.
查看答案和解析>>
科目:gzhx
来源:浙江省模拟题
题型:填空题
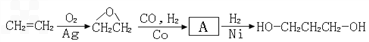
1,3-丙二醇是生产新型高分子材料PTT的主要原料,目前其生产路线有以下几种:
(1)有机物A含有的官能团为
____________。
(2)从合成原料来源的角度看,你认为最具有发展前景的路线是
_______(填1、2或3),理由是
____________。
(3)以1,3-丙二醇与对苯二甲酸(
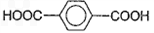
)为原料可以合成聚酯PTT,写出其化学方程式
______________。
(4)已知丙二酸二乙酯能发生以下反应:
以丙二酸二乙酯、1,3-丙二醇、乙醇为原料(无机物任选)合成

,再转化为
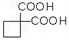
。
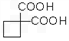
的同分异构体不可能属于__________。
a.醇 b.酚 c.醛 d.酯
(5)要合成
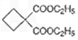
,必须先合成哪些物质?(用合成该物质的化学方程式回答)
__________。
(6)化合物B~E的转化关系如下图所示,其中足量的新制Cu(OH)
2悬浊液与1 mol B反应可生成1 mol Cu
2O 和1 mol C。写出符合下列条件的D的同分异构体的结构简式。
①含有三个甲基; ②能与乙醇发生酯化反应; ③-OH、-Br连在同一个碳原子上。
________________________________________________________________
查看答案和解析>>
科目:gzhx
来源:
题型:实验题
乙醇在一定条件下可被氧化,某同学利用下列装置进行乙醇的催化氧化实验,并检验其产物,其中C装置的试管中盛有无水乙醇。已知乙醛在加热条件下能与新制Cu(OH)2悬浊液反应生成Cu2O。(代表酒精灯)

回答下列问题:
(1)请选择必要的装置,按气流方向连接顺序为 __(填仪器接口的字母编号)(加热和夹持装置已略去)。
(2)B装置的分液漏斗中液体药品是 _(填化学式)。该液体还可以与酸性KMnO4溶液反应产生相同的气体,写出该反应的离子方程式 。
(3)F装置中的固体试剂是 ,发生反应的化学方程式为 。反应一段时间后移去酒精灯,反应能继续进行,其原因是 。
(4)A装置和D装置中的实验现象分别为 、 。
(5)为了提高乙醇的转化率,可以对C装置进行改进,提出你的改进意见 。
查看答案和解析>>
科目:gzhx
来源:2014高考化学二轮复习限时集训 专题14综合实验与探究练习卷A(解析版)
题型:实验题
乙醇在一定条件下可被氧化,某同学利用下列装置进行乙醇的催化氧化实验,并检验其产物,其中C装置的试管中盛有无水乙醇。已知乙醛在加热条件下能与新制Cu(OH)2悬浊液反应生成Cu2O。(代表酒精灯)

回答下列问题:
(1)请选择必要的装置,按气流方向连接顺序为 __(填仪器接口的字母编号)(加热和夹持装置已略去)。
(2)B装置的分液漏斗中液体药品是 _(填化学式)。该液体还可以与酸性KMnO4溶液反应产生相同的气体,写出该反应的离子方程式 。
(3)F装置中的固体试剂是 ,发生反应的化学方程式为 。反应一段时间后移去酒精灯,反应能继续进行,其原因是 。
(4)A装置和D装置中的实验现象分别为 、 。
(5)为了提高乙醇的转化率,可以对C装置进行改进,提出你的改进意见 。
查看答案和解析>>
科目:gzhx
来源:不详
题型:实验题
乙醇在一定条件下可被氧化,某同学利用下列装置进行乙醇的催化氧化实验,并检验其产物,其中C装置的试管中盛有无水乙醇。已知乙醛在加热条件下能与新制Cu(OH)
2悬浊液反应生成Cu
2O。(代表酒精灯)

回答下列问题:
(1)请选择必要的装置,按气流方向连接顺序为
__(填仪器接口的字母编号)(加热和夹持装置已略去)。
(2)B装置的分液漏斗中液体药品是
_(填化学式)。该液体还可以与酸性KMnO
4溶液反应产生相同的气体,写出该反应的离子方程式
。
(3)F装置中的固体试剂是
,发生反应的化学方程式为
。反应一段时间后移去酒精灯,反应能继续进行,其原因是
。
(4)A装置和D装置中的实验现象分别为
、
。
(5)为了提高乙醇的转化率,可以对C装置进行改进,提出你的改进意见
。
查看答案和解析>>
科目:gzhx
来源:
题型:
乙醇在一定条件下可被氧化,某同学利用下列装置进行乙醇的催化氧化实验,并检验其产物,其中C装置的试管中盛有无水乙醇.已知乙醛在加热条件下能与新制Cu(OH)
2反应生成Cu
2O.

回答下列问题:
(1)请选择必要的装置,按气流方向连接顺序为
(填仪器接口的字母编号)(加热和夹持装置已略去).
(2)B装置的分液漏斗中液体药品是
(填化学式).该液体还可以与酸性KMnO
4溶液反应产生相同的气体,写出该反应的离子方程式
.
(3)F装置中的固体试剂是
,发生反应的化学方程式为
.反应一断时间后移去酒精灯,反应能继续进行,其原因是
.
(4)A装置和D装置中的实验现象分别为
、
.
(5)为了提高乙醇的转化率,可以对C装置进行改进,提出你的改进意见
.
查看答案和解析>>
科目:gzhx
来源:
题型:解答题
6.乙醇在一定条件下可被氧化,某同学利用下列装置进行乙醇的催化氧化实验,并检验其产物,其中C装置的试管中盛有无水乙醇.
已知乙醛在加热条件下能与新制Cu(OH)
2反应生成Cu
2O.
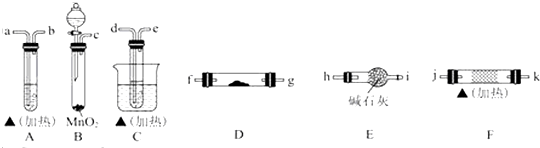
回答下列问题:
(1)请选择必要的装置,按气流方向连接顺序为c→hi→de→jk(或kj)→fg(或gf)→a(填仪器接口的字母编号)(加热和夹持装置已略去).
(2)B装置中发生的化学方程式2H
2O
2$\frac{\underline{\;二氧化锰\;}}{\;}$2H
2O+O
2↑.
(3)F装置中的固体试剂是铜丝,发生反应的化学方程式为2CH
3CH
2OH+O
2$→_{△}^{催化剂}$2CH
3CHO+2H
2O.反应一断时间后移去酒精灯,反应能继续进行,其原因是该反应为放热反应,反应过程放出的热量能维持反应继续进行.
(4)A装置和D装置中的实验现象分别为A中出现砖红色沉淀、D中白色粉末变为蓝色.
(5)为了提高乙醇的转化率,可以对C装置进行改进,提出你的改进意见使用温度计,控制C装置中水浴的温度略高于乙醇沸点.
查看答案和解析>>
科目:gzhx
来源:
题型:

科学研究发现Cu
2O可作为太阳光分解水的催化剂.
Ⅰ.通过以下四种方法来制备Cu
2O.
a.火法还原:用炭粉在高温条件下还原CuO;
b.用CH
3CHO还原新制的Cu(OH)
2:
c.电解法:2Cu+H
2O
Cu
2O+H
2↑;
d.最新实验研究用肼(N
2H
4)还原新制Cu(OH)
2可制备纳米级Cu
2O,同时放出N
2;该法的化学方程式为
.
Ⅱ.用制得的Cu
2O进行催化分解水的实验.
(1)一定温度下,在2L密闭容器中加入纳米级Cu
2O并通入0.10mol水蒸气,发生反应:2H
2O(g)═2H
2g)+O
2(g)△H=+484kJ/mol.测得不同时段产生O
2的量见下表:
| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |
前20min的反应速率 v(H
2O)=
;该条件下,反应达平衡时,至少需要吸收的光能为
kJ.
(2)用以上四种方法制得的Cu
2O在相同条件下分别对水进行催化分解,产生氢气的体积V(H
2)随时间t变化如图所示,则下列说法正确的是
.
A.c、d方法制得的Cu
2O催化效率相对较高
B.d方法制得的Cu
2O作催化剂时,水的平衡转化率最高
C.催化效果与Cu
2O颗粒的粗细、表面活性等有关
D.分解等物质的量的水时,d方法制得的Cu
2O作催化剂所需吸收的能量最低.
查看答案和解析>>
科目:gzhx
来源:
题型:

科学研究发现Cu
2O可作为太阳光分解水的催化剂.
Ⅰ.通过以下四种方法来制备Cu
2O.
a.火法还原:用炭粉在高温条件下还原CuO;
b.用CH
3CHO还原新制的Cu(OH)
2:该制法的化学方程式为
;
c.电解法:2Cu+H
2O Cu
2O+H
2↑;
d.最新实验研究用肼(N
2H
4)还原新制Cu(OH)
2可制备纳米级Cu
2O,同时放出N
2.该制法的化学方程式为
.
Ⅱ.用制得的Cu
2O进行催化分解水的实验.
(1)一定温度下,在2L密闭容器中加入纳米级Cu
2O并通入0.10mol水蒸气,发生反应:2H
2O(g)═2H
2(g)+O
2(g)△H=+484kJ/mol.测得不同时段产生O
2的量见下表:
| 时间/min |
20 |
40 |
60 |
80 |
| n(O2)/mol |
0.0010 |
0.0016 |
0.0020 |
0.0020 |
前20min的反应速率 v(H
2O)=
;该条件下,反应达平衡时,至少需要吸收的光能为
kJ.
(2)用以上四种方法制得的Cu
2O在相同条件下分别对水进行催化分解,产生氢气的体积V(H
2)随时间t变化如图所示,则下列说法正确的是
.
A.c、d方法制得的Cu
2O催化效率相对较高
B.d方法制得的Cu
2O作催化剂时,水的平衡转化率最高
C.催化效果与Cu
2O颗粒的粗细、表面活性等有关
D.分解等物质的量的水时,d方法制得的Cu
2O作催化剂所需吸收的能量最低.
查看答案和解析>>
科目:gzhx
来源:
题型:
科学研究发现纳米级的Cu
2O可作为太阳光分解水的催化剂.
Ⅰ.四种制取Cu
2O的方法
(1)火法还原.用炭粉在高温条件下还原CuO;
(2)用葡萄糖[CH
2OH(CHOH)
4CHO]还原新制的Cu(OH)
2.写出化学方程式
;
(3)电解法.反应为2Cu+H
2O
Cu
2O+H
2↑.则阳极产物是
;
(4)最新实验研究用肼(N
2H
4)还原新制Cu(OH)
2可制备纳米级Cu
2O,同时放出N
2.该制法的化学方程式为
.
Ⅱ.用制得的Cu
2O进行催化分解水的实验
(1)一定温度下,在2L密闭容器中加入纳米级Cu
2O并通入0.10mol水蒸气,发生反应:
2H
2O(g)
2H
2(g)+O
2(g);△H=+484kJ•mol
-1,不同时段产生O
2的量见下表:
| 时间/min |
20 |
40 |
60 |
80 |
| n(O2)/mol |
0.0010 |
0.0016 |
0.0020 |
0.0020 |
计算:
前20min的反应速率 v(H
2O)=
;该反应的平衡常数表达式K=
;达平衡时,至少需要吸收的光能为
kJ.
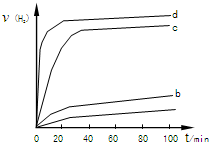
(2)用以上四种方法制得的Cu
2O在某相同条件下分别对水催化分解,产生氢气的速率v随时间t变化如图所示.下列叙述正确的是
.
A.c、d方法制得的Cu
2O催化效率相对较高
B.d方法制得的Cu
2O作催化剂时,水的平衡转化率最高
C.催化效果与Cu
2O颗粒的粗细、表面活性等有关
D.Cu
2O催化水分解时,需要适宜的温度.
查看答案和解析>>
科目:gzhx
来源:
题型:解答题
17.化合物G是一种医药中间体,常用于制备抗凝血药,可以通过下图所示的路线合成:
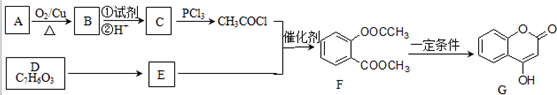
已知:RCOOH$\stackrel{PCl_{3}}{→}$RCOCl
请回答下列问题:
(1)B→C的转化所加的试剂可能是银氨溶液或新制Cu(OH)
2悬浊液C+E→F的反应类型是取代反应.
(2)有关G的下列说法正确的是bd.
a.属于芳香烃
b.可以发生水解、加成、氧化、酯化等反应
c.能与FeCl
3溶液发生显色反应
d.1molG最多可以跟4molH
2反应
(3)E的结构简式:
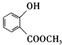
.
(4)F与足量NaOH溶液充分反应的化学方程式为
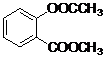
+3NaOH$\stackrel{△}{→}$

+CH
3COONa+CH
3OH+H
2O.
(5)E的同分异构体中,既能发生水解反应,又能与FeCl
3溶液能发生显色反应的还有18种,其中苯环上有两种不同化学环境的氢原子的是

(写出其中一种的结构简式).
(6)已经氯苯用10%到15%的氢氧化钠溶液在360到390℃、28-30MPa条件下水解再酸化,
可制取苯酚,而酚羟基一般不易直接与羧酸酯化.
苯甲酸苯酚酯(

)是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任用).
注:合成路线的书写格式参加如下示例流程图:CH
3CHO$→_{催化剂}^{O_{2}}$CHCOOH
3$→_{浓硫酸}^{CH_{3}CH_{2}OH}$CH
3COOCH
2CH
3.
查看答案和解析>>
科目:gzhx
来源:
题型:解答题
13.化合物Ⅳ为一种重要化工中间体,其合成方法如下:
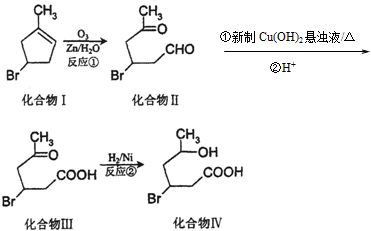
(1)化合物Ⅰ在核磁共振氢谱图吸收峰个数为5;反应②的反应类型为加成反应(或还原反应).
(2)化合物Ⅱ与新制Cu(OH)
2悬浊液反应,写出该反应的化学方程式
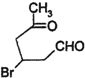
+2Cu(OH)
2$\stackrel{△}{→}$
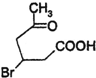
+Cu
2O↓+2H
2O.
(3)化合物I在NaOH醇溶液中加热反应得到化合物X,X的结构简式可能是
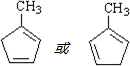
.
(写出任意一种的结构简式).
(4)化合物III与足量NaOH水溶液加热反应的化学方程式为
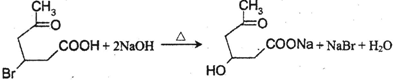
.
(5)异黄樟油素
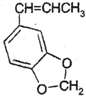
发生类似反应①的反应,得到乙醛和化合物Y,Y的结构简式为
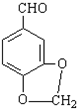
.
(6)有关上述化合物,说法不正确的是AE
A.1mol化合物Ⅲ,最多可与2molH
2反应 B.化合物Ⅳ在一定条件下能与HBr反应
C.化合物Ⅰ能使酸性高锰酸钾溶液褪色 D.化合物Ⅳ在一定条件下能发生缩聚反应
E.化合物Ⅱ分子式为C
6H
11O
2Br.
查看答案和解析>>
科目:gzhx
来源:同步题
题型:填空题
已知:

(1)该反应的生成物中含有的官能团的名称是____________,在一定条件下能发生__________(填序号)。
①银镜反应②酯化反应③还原反应
(2)某氯代烃A的分子式为C6H11Cl,它可以发生如下转化:
结构分析表明E分子中含有2个甲基且没有支链。试回答:
①有关C的说法正确的是____。
a.分子式为C6H10O2
b.C属于醛类,且1molC与足量的新制的Cu(OH)2反应可生成4molCu2O
c.C具有氧化性,也具有还原性
d.由B催化氧化可以得到C
②写出下列转化关系的化学方程式,并指出反应类型。 A→B:_______,______; D→E:_______,_______。
查看答案和解析>>
科目:gzhx
来源:
题型:
根据下列流程处理废旧电路板来回收金属Cu,并制得高铁酸钾(K
2FeO
4).据此回答问题:
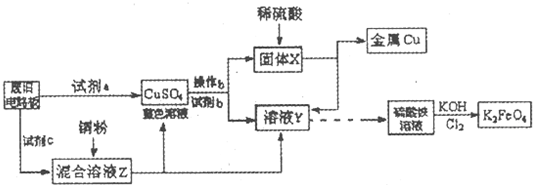
(1)试剂a为
,试剂b为
(填写所选试剂代号)
A.浓硫酸 B.硫酸铁溶液 C.氯水 D.H
2O
2和稀硫酸 E.Fe
(2)加入过量试剂c,发生反应的离子方程式为
;溶液Z中金属离子可能有Cu
2+、Fe
2+、Fe
3+,检验Fe
3+的试剂为
(填化学式);欲测定溶液Z中Fe
2+的浓度,需要用(填仪器名称)
配制一定浓度的KMnO
4标准溶液.在滴定时KMnO
4标准溶液应加入到
(填“酸式”或“碱式”)滴定管中.
(3)K
2FeO
4是强氧化剂,与水发生反应:4FeO
42-+10H
2O═4Fe(OH)
3(胶体)+3O
2↑+8OH
-,产生11.2L(标况)O
2时,转移电子的物质的量为
.K
2FeO
4与FeCl
3相比,净水效果更好的是
,理由是
.
(4)高铁电池是一种新型可充电电池,总反应为:3Zn+2K
2FeO
4+8H
2O
3Zn(OH)
2+2Fe(OH)
3+4KOH,该电池放电时正极反应式是:
.
查看答案和解析>>
科目:gzhx
来源:
题型:
根据下列流程处理废旧电路板来回收金属Cu,并制得高铁酸钾(K2 FeO4)。
据此回答问题:
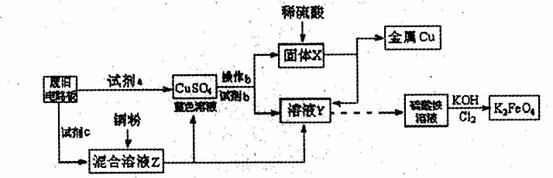
A.浓硫酸 B.硫酸铁溶液 C.氯水
D.H2 O2和稀硫酸 E. Fe
(2)加入过量试剂c,发生反应的离子方程式为__ ;溶液Z中金属离子可能有Cu2+、Fe2+、Fe3+,检验Fe3+的试剂为__ _ _(填化学式);欲测定溶液Z中Fe2+的浓度,需要用(填仪器名称)__ __配制一定浓度的KMnO4标准溶液。在滴定时KMnO4标准溶液应加入到 (填“酸式”或“碱式”)滴定管中。
(3) K2FeO4是强氧化剂,与水发生反应:4FeO42-+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-,产生11.2L(标况)02时,转移电子的物质的量为 。K2Fe04与FeCl3相比,净水效果更好的是_ ,理由是 。
(4)高铁电池是一种新型可充电电池,总反应为:32n +2K2FeO4 +8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,该电池放电时正极反应式是: 。
3Zn(OH)2+2Fe(OH)3+4KOH,该电池放电时正极反应式是: 。
查看答案和解析>>


 .
. .
. 
 2H2(g)+O2 (g) △H=+484kJ/mol 不同时段产生O2的量见下表
2H2(g)+O2 (g) △H=+484kJ/mol 不同时段产生O2的量见下表

 Cu2O+H2↑,则阳极产物是___。
Cu2O+H2↑,则阳极产物是___。  2H2(g)+ O2(g) △H=+484 kJ.mol-1,不同时间内产生O2的量如下表:
2H2(g)+ O2(g) △H=+484 kJ.mol-1,不同时间内产生O2的量如下表: 
 2H2(g)+O2(g) △H=+484 kJ/mol 不同时段产生O2的量见下表
2H2(g)+O2(g) △H=+484 kJ/mol 不同时段产生O2的量见下表 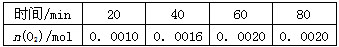

Cu2O + H2↑。则阳极产物是 ;
![]() 2H2(g)+O2(g);△H = +484kJ・mol-1,不同时段产生O2的量见下表:
2H2(g)+O2(g);△H = +484kJ・mol-1,不同时段产生O2的量见下表:

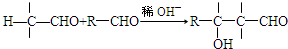

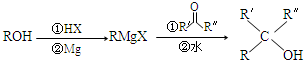
 .X与苯酚生成高聚物反应的化学方程式
.X与苯酚生成高聚物反应的化学方程式 .
. .
. .
. 
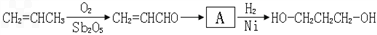
 )为原料可以合成聚酯PTT,写出其化学方程式 ______________。
)为原料可以合成聚酯PTT,写出其化学方程式 ______________。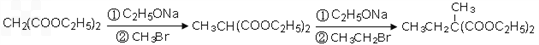
 ,再转化为
,再转化为  。
。 的同分异构体不可能属于__________。
的同分异构体不可能属于__________。  ,必须先合成哪些物质?(用合成该物质的化学方程式回答) __________。
,必须先合成哪些物质?(用合成该物质的化学方程式回答) __________。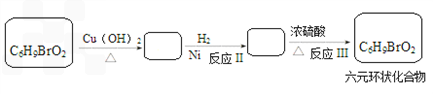





 科学研究发现Cu2O可作为太阳光分解水的催化剂.
科学研究发现Cu2O可作为太阳光分解水的催化剂. 科学研究发现Cu2O可作为太阳光分解水的催化剂.
科学研究发现Cu2O可作为太阳光分解水的催化剂.

 .
.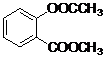 +3NaOH$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$ +CH3COONa+CH3OH+H2O.
+CH3COONa+CH3OH+H2O. (写出其中一种的结构简式).
(写出其中一种的结构简式). )是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任用).
)是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任用).
 +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$ +Cu2O↓+2H2O.
+Cu2O↓+2H2O. .
. .
. 发生类似反应①的反应,得到乙醛和化合物Y,Y的结构简式为
发生类似反应①的反应,得到乙醛和化合物Y,Y的结构简式为 .
.
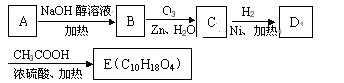


![]() 3Zn(OH)2+2Fe(OH)3+4KOH,该电池放电时正极反应式是: 。
3Zn(OH)2+2Fe(OH)3+4KOH,该电池放电时正极反应式是: 。