
科目:gzhx 来源: 题型:
| c2(NO) |
| c(N2)c(O2) |
| c2(NO) |
| c(N2)c(O2) |
 ①由此推知,反应 N2(g)+O2(g)⇌2NO(g)为(填“吸热”或“放热”)
①由此推知,反应 N2(g)+O2(g)⇌2NO(g)为(填“吸热”或“放热”)科目:gzhx 来源:2010年浙江省舟山市定海区四校联考高考化学模拟试卷(解析版) 题型:解答题
 ①由此推知,反应 N2(g)+O2(g)⇌2NO(g)为(填“吸热”或“放热”)______反应.
①由此推知,反应 N2(g)+O2(g)⇌2NO(g)为(填“吸热”或“放热”)______反应.科目:gzhx 来源:2011年广东省茂名市高州市南塘中学高考化学一模试卷(解析版) 题型:解答题
 ①由此推知,反应 N2(g)+O2(g)⇌2NO(g)为(填“吸热”或“放热”)______反应.
①由此推知,反应 N2(g)+O2(g)⇌2NO(g)为(填“吸热”或“放热”)______反应.科目:gzhx 来源:2010年北京市海淀区高考化学二模试卷(5月份)(解析版) 题型:解答题
 ①由此推知,反应 N2(g)+O2(g)⇌2NO(g)为(填“吸热”或“放热”)______反应.
①由此推知,反应 N2(g)+O2(g)⇌2NO(g)为(填“吸热”或“放热”)______反应.科目:gzhx 来源: 题型:
A、B、C、D是常见不同主族的短周期元素,它们的原子序数逐渐增大,A元素原子最外层电子数是内层电子数的2倍;其中只有C是金属元素,且C元素原子最外层电子数是D元素原子最外层电子数的一半;B元素原子的最外层电子数比D元素原子最外层电子数少一个;E与D同主族,且E元素的非金属性比D强。
(1)写出A、B、E三种元素的元素符号:
A: B: E: 。
(2)如图所示:以C和A的单质为电极材料,两池内的电解质溶液均为D的最高价氧化物对应的水化物。a中A为 极,电池总反应的离子方程式为 ;b中A上的电极反应式为 ,一段时间后b中的pH(填“变大”、“变小”、或“不变”).
(3)工业利用CO(g)+H2O(g)H2(g)+CO2(g)
反应来制备合成氨的原料气,在1000℃下,用
高压水蒸气洗涤混合气体,再经过处理后即可直接作为合成氨的原料气。高温、高压处理的理由是 。
(4)汽车内燃机工作时产生的高温会引起N2和O2的反应N2(g)+O2(g) 2NO(g),这是导致汽车尾气中含有NO的原因之一,该反应在不同温度下的平衡常数K如下表:
| 温度 | 27℃ | 2000℃ |
| K值 | 3.84×10-31 | 0.1 |
该反应为 反应(填“放热”、“吸热”);T℃时,该反应化学平衡常数K=1,当c(N2):c(O2):c2(NO)=1:1:l,则可逆反应的反应速率(v)应满足的关系为 。
A.v(正)>v(逆) B.v(正)<v(逆)
C.v(正)=v(逆) D.无法确定
科目:gzhx 来源:2010-2011学年广东省茂名市高三第一次模拟考试(理综)化学部分 题型:填空题
A、B、C、D是常见不同主族的短周期元素,它们的原子序数逐渐增大,A元素原子最外层电子数是内层电子数的2倍;其中只有C是金属元素,且C元素原子最外层电子数是D元素原子最外层电子数的一半;B元素原子的最外层电子数比D元素原子最外层电子数少一个;E与D同主族,且E元素的非金属性比D强。

(1)写出A、B、E三种元素的元素符号:
A: B: E: 。
(2)如图所示:以C和A的单质为电极材料,两池内的电解质溶液均为D的最高价氧化物对应的水化物。a中A为 极,电池总反应的离子方程式为 ;b中A上的电极反应式为 ,一段时间后b中的pH(填“变大”、“变小”、或“不变”).
(3)工业利用CO(g)+H2O(g)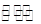 H2(g)+CO2(g)
H2(g)+CO2(g)
 反应来制备合成氨的原料气,在1000℃下,用
反应来制备合成氨的原料气,在1000℃下,用
高压水蒸气洗涤混合气体,再经过处理后即可直接作为合成氨的原料气。高温、高压处理的理由是 。
(4)汽车内燃机工作时产生的高温会引起N2和O2的反应N2(g)+O2(g) 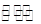 2NO(g),这是导致汽车尾气中含有NO的原因之一,该反应在不同温度下的平衡常数K如下表:
2NO(g),这是导致汽车尾气中含有NO的原因之一,该反应在不同温度下的平衡常数K如下表:
|
温度 |
27℃ |
2000℃ |
|
K值 |
3.84×10-31 |
0.1 |
该反应为 反应(填“放热”、“吸热”);T℃时,该反应化学平衡常数K=1,当c(N2):c(O2):c2(NO)=1:1:l,则可逆反应的反应速率(v)应满足的关系为 。
A.v(正)>v(逆) B.v(正)<v(逆)
C.v(正)=v(逆) D.无法确定
科目:gzhx 来源:2011届广东省茂名市高三第一次模拟考试(理综)化学部分 题型:填空题
A、B、C、D是常见不同主族的短周期元素,它们的原子序数逐渐增大,A元素原子最外层电子数是内层电子数的2倍;其中只有C是金属元素,且C元素原子最外层电子数是D元素原子最外层电子数的一半;B元素原子的最外层电子数比D元素原子最外层电子数少一个;E与D同主族,且E元素的非金属性比D强。
(1)写出A、B、E三种元素的元素符号:
A: B: E: 。
(2)如图所示:以C和A的单质为电极材料,两池内的电解质溶液均为D的最高价氧化物对应的水化物。a中A为 极,电池总反应的离子方程式为 ;b中A上的电极反应式为 ,一段时间后b中的pH(填“变大”、“变小”、或“不变”).
(3)工业利用CO(g)+H2O(g)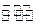 H2(g)+CO2(g)
H2(g)+CO2(g) 反应来制备合成氨的原料气,在1000℃下,用
反应来制备合成氨的原料气,在1000℃下,用
高压水蒸气洗涤混合气体,再经过处理后即可直接作为合成氨的原料气。高温、高压处理的理由是 。
(4)汽车内燃机工作时产生的高温会引起N2和O2的反应N2(g)+O2(g) 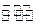 2NO(g),这是导致汽车尾气中含有NO的原因之一,该反应在不同温度下的平衡常数K如下表:
2NO(g),这是导致汽车尾气中含有NO的原因之一,该反应在不同温度下的平衡常数K如下表:
| 温度 | 27℃ | 2000℃ |
| K值 | 3.84×10-31 | 0.1 |
科目:gzhx 来源: 题型:阅读理解
A、B、C、D是常见不同主族的短周期元素,它们的原子序数逐渐增大,A元素原子最外层电子数是内层电子数的2倍;其中只有C是金属元素,且C元素原子最外层电子数是D元素原子最外层电子数的一半;B元素原子的最外层电子数比D元素原子最外层电子数少一个;E与D同主族,且E元素的非金属性比D强。
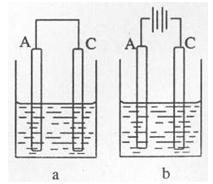
(1)写出A、B、E三种元素的元素符号:
A: B: E: 。
(2)如图所示:以C和A的单质为电极材料,两池内的电解质溶液均为D的最高价氧化物对应的水化物。a中A为 极,电池总反应的离子方程式为 ;b中A上的电极反应式为 ,一段时间后b中的pH(填“变大”、“变小”、或“不变”).
(3)工业利用CO(g)+H2O(g)![]() H2(g)+CO2(g)
H2(g)+CO2(g)
![]() 反应来制备合成氨的原料气,在1000℃下,用
反应来制备合成氨的原料气,在1000℃下,用
高压水蒸气洗涤混合气体,再经过处理后即可直接作为合成氨的原料气。高温、高压处理的理由是 。
(4)汽车内燃机工作时产生的高温会引起N2和O2的反应N2(g)+O2(g) ![]() 2NO(g),这是导致汽车尾气中含有NO的原因之一,该反应在不同温度下的平衡常数K如下表:
2NO(g),这是导致汽车尾气中含有NO的原因之一,该反应在不同温度下的平衡常数K如下表:
| 温度 | 27℃ | 2000℃ |
| K值 | 3.84×10-31 | 0.1 |
该反应为 反应(填“放热”、“吸热”);T℃时,该反应化学平衡常数K=1,当c(N2):c(O2):c2(NO)=1:1:l,则可逆反应的反应速率(v)应满足的关系为 。
A.v(正)>v(逆) B.v(正)<v(逆)
C.v(正)=v(逆) D.无法确定
科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:阅读理解
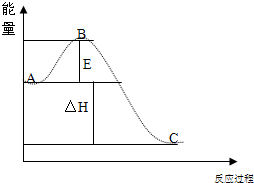 (2010•祁阳县一模)一氧化碳、二氧化硫和氮的氧物是重要的化工原料,但也是大气的主要污染物,综合治理其污染是环境化学当前的重要研究内容之一.
(2010•祁阳县一模)一氧化碳、二氧化硫和氮的氧物是重要的化工原料,但也是大气的主要污染物,综合治理其污染是环境化学当前的重要研究内容之一.科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:
| ||
| ||
科目:gzhx 来源:2011-2012年重庆西南大学附中高一下学期期中考试化学试卷(解析版) 题型:填空题
(12分)化学与人类社会可持续发展密切相关,能源、环境、材料以及日常生活等都离不开化学。
(1)乐山是国家级硅材料产业基地,硅材料是无机非金属材料的主角。请你举出两种含硅的材料名称 、 。用氢气在高温下还原SiCl4是高纯硅生产过程中的一个环节,写出该反应的化学方程式 。
(2)大量使用化石燃料,最直接的危害是造成“温室效应”、“酸雨”等环境问题。为了防治酸雨,降低煤燃烧时向大气排放的SO2,某硫酸工厂上使用石灰乳吸收尾气,涉及的化学方程式为:
(3)汽车尾气中的NO、CO已经成为许多城市空气的主要污染源。但汽车的燃料中一般不含氮元素,尾气中的NO从何而来?写出有关化学方程式 ;治理汽车尾气中NO和CO的一种方法是:在汽车排气管上装一个催化转化装置,使NO与CO反应,生成CO2和N2,写出反应的化学方程式 。
科目:gzhx 来源:2011-2012年重庆西南大学附中高一下学期期中考试化学试卷(带解析) 题型:填空题
(12分)化学与人类社会可持续发展密切相关,能源、环境、材料以及日常生活等都离不开化学。
(1)乐山是国家级硅材料产业基地,硅材料是无机非金属材料的主角。请你举出两种含硅的材料名称 、 。用氢气在高温下还原SiCl4是高纯硅生产过程中的一个环节,写出该反应的化学方程式 。
(2)大量使用化石燃料,最直接的危害是造成“温室效应”、“酸雨”等环境问题。为了防治酸雨,降低煤燃烧时向大气排放的SO2,某硫酸工厂上使用石灰乳吸收尾气,涉及的化学方程式为:
(3)汽车尾气中的NO、CO已经成为许多城市空气的主要污染源。但汽车的燃料中一般不含氮元素,尾气中的NO从何而来?写出有关化学方程式 ;治理汽车尾气中NO和CO的一种方法是:在汽车排气管上装一个催化转化装置,使NO与CO反应,生成CO2和N2,写出反应的化学方程式 。
科目:gzhx 来源:2011-2012年河北广平一中高二第二次调研考试(文)化学试卷(解析版) 题型:填空题
(6分)目前,汽车尾气已成为许多大城市空气的主要污染源。汽车尾气中含有CO、NO等多种污染物。
(1)汽车燃料中一般不含氮元素,为其中所含的NO是如何产生的?用化学方程式表示:
(2)治理汽车尾气中NO和CO的一种方法是:在汽车的排气管上装一个催化转化装置,使NO与CO反应,生成CO2和N2。反应的化学方程式是
(3)下列措施中,能减少或控制汽车尾气污染有效且可行的是
A. 制定严格的汽车尾气排放标准,并严格执行。
B. 开发清洁能源汽车,如氢能汽车、太阳能汽车等。
C. 市民出行戴防护面具。
D. 市民大量移居城市郊区。
科目:gzhx 来源:2013年吉林省延边州安图县长白山一中高考化学二轮复习试卷(一)(解析版) 题型:选择题
科目:gzhx 来源:2014届河北省高二第三次考试化学试卷(解析版) 题型:实验题
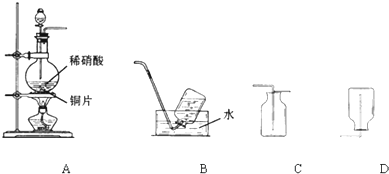
(11分)某实验小组的同学为探究一氧化氮的性质,欲选用下列实验装置来制取一氧化氮。
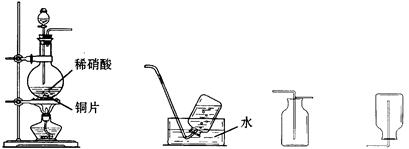
A B C D
请回答下列问题:
(1)用上图中所示的装置制取一氧化氮,选用仪器连接的顺序应是A接_________。
(2)现欲用15 mol/L HNO3溶液配制500 mL、1 mol/L HNO3溶液时,要用到的仪器除烧杯、胶头滴管、玻璃棒、量筒外,还必须使用的一种玻璃仪器是 。
(3)稀硝酸具有强氧化性,在常温下就可以和铜发生反应生成一氧化氮气体,写出该反应的化学方程式:___________________________________________________。
(4)实验开始时,该小组同学发现在烧瓶中有红棕色气体产生,请你用化学方程式来表示产生这种现象的原因:_________________________________________________。
(5)一氧化氮和一氧化碳是汽车尾气中的主要污染物。目前,汽车尾气已成为许多大城市空气的主要污染源。治理汽车尾气中的NO和CO的一种方法是:在汽车的排气管上装一个催化转化装置,使NO与CO反应,生成CO2和N2。反应的化学方程式是 。
科目:gzhx 来源: 题型:
(6分)目前,汽车尾气已成为许多大城市空气的主要污染源。汽车尾气中含有CO、NO等多种污染物。
(1)汽车燃料中一般不含氮元素,为其中所含的NO是如何产生的?用化学方程式表示:
(2)治理汽车尾气中NO和CO的一种方法是:在汽车的排气管上装一个催化转化装置,使NO与CO反应,生成CO2和N2。反应的化学方程式是
(3)下列措施中,能减少或控制汽车尾气污染有效且可行的是
A. 制定严格的汽车尾气排放标准,并严格执行。
B. 开发清洁能源汽车,如氢能汽车、太阳能汽车等。
C. 市民出行戴防护面具。
D. 市民大量移居城市郊区。